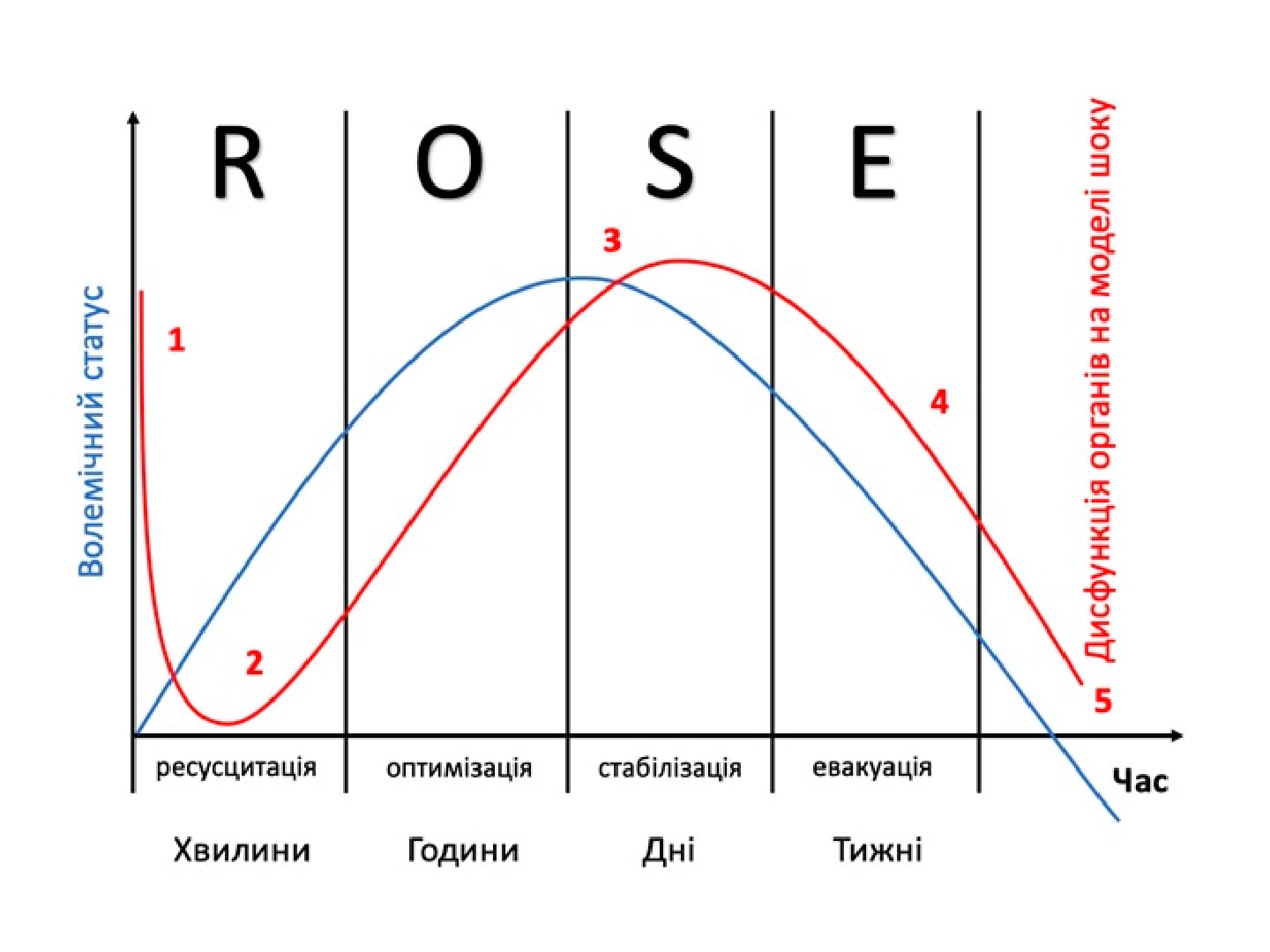
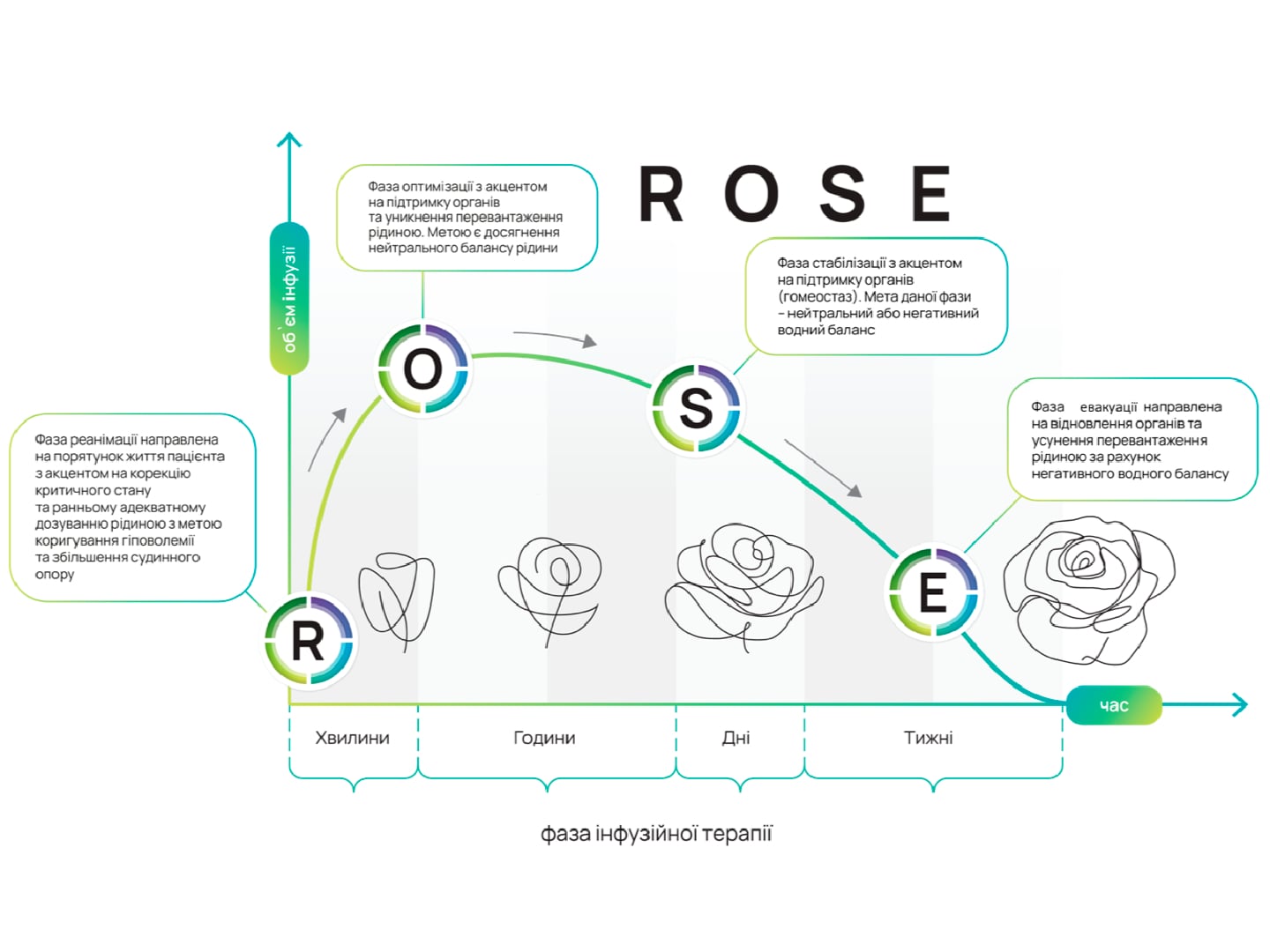
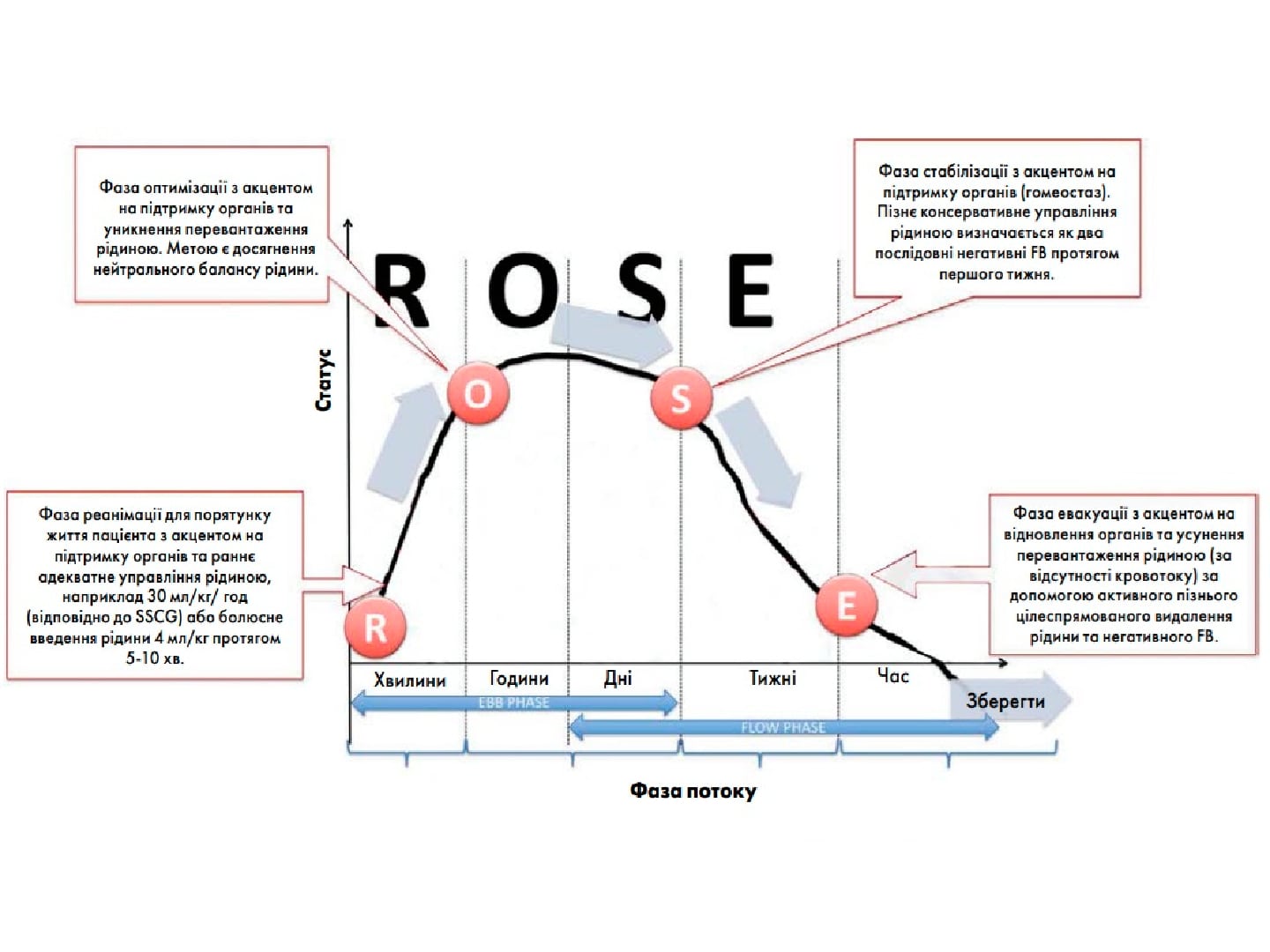
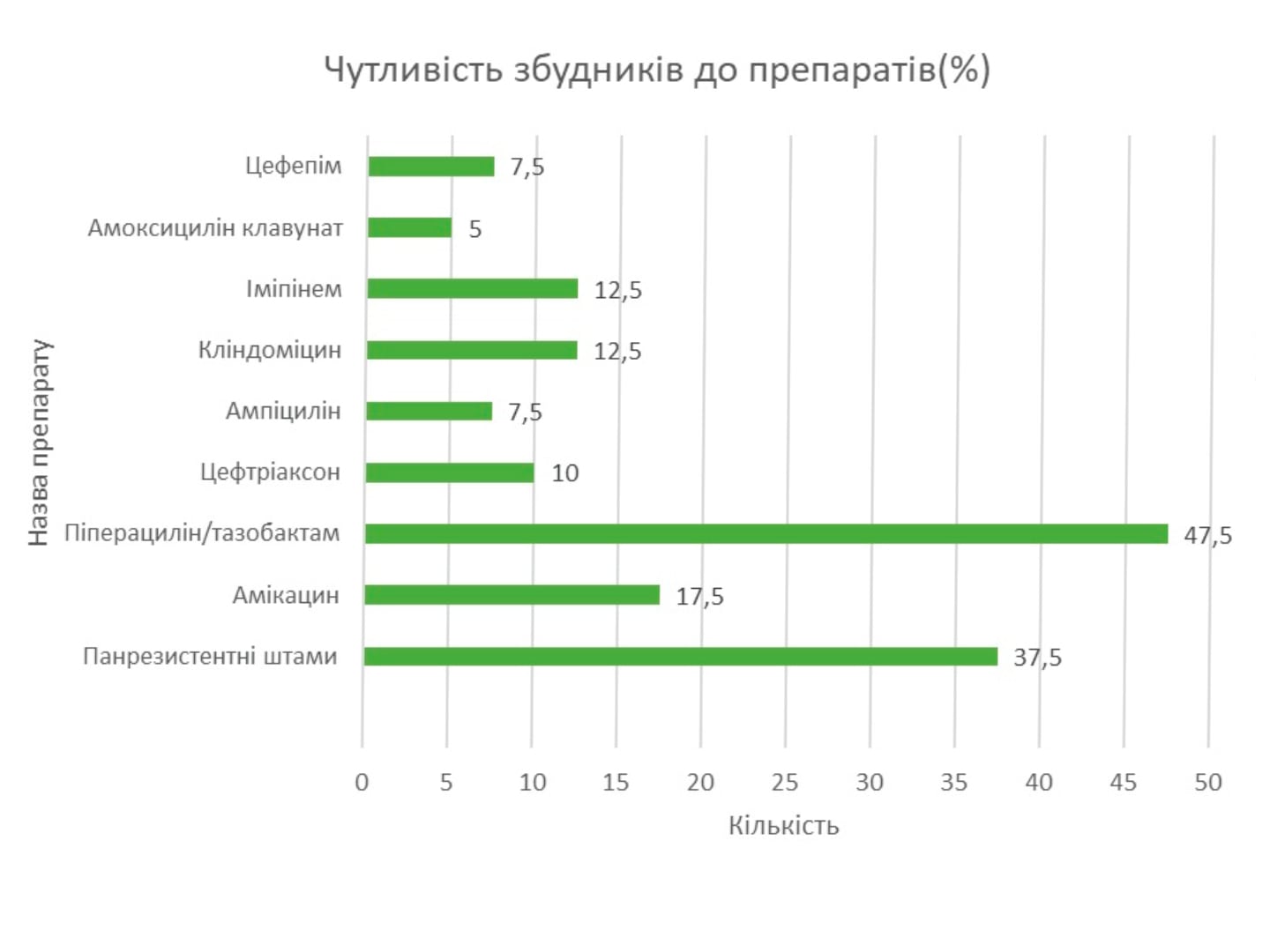
Застосування інфузійної терапії при COVID-19
Раціональна інфузійна терапія у пацієнтів із COVID-19 є однією з найбільш актуальних проблем сьогодення. Визначення показань, доцільних методів контролю за адекватністю проведеної терапії, а також найбільш ефективних інфузійних розчинів є важливим завданням сучасних лікарів та науковців в умовах пандемії COVID-19.
Ключові слова: коронавірусна інфекція, COVID-19, інфузійна терапія, гіповолемія.
Новою пандемією, що загрожує людству у ХХІ столітті, є коронавірусна інфекція COVID-19, викликана вірусом SARSCoV-2. Згідно з даними Всесвітньої організації охорони здоров’я (ВООЗ), станом на січень 2021 року у світі зареєстровано майже 90 млн випадків захворювання, з яких понад 1,9 млн призвели до летального кінця [1]. Пандемія COVID-19 не оминула й Україну. За даними МОЗ України, станом на 12 січня зареєстровано 1,115 млн випадків захворювання, з яких 19 767 стали летальними [2].
COVID-19 та його ускладнення є найбільш актуально досліджуваною проблемою у більшості країн світу, оскільки немає чіткого розуміння патогенезу даного захворювання. Дедалі більше вчених схиляються до думки, що COVID-19 – це васкуліт, який супроводжується станом гіперкоагуляції, що в подальшому призводить до розвитку тромбоемболічних ускладнень [3]. Проведення раціональної інфузійної терапії у пацієнтів із тяжким перебігом COVID-19 є надзвичайно важливим завданням, особливо враховуючи те, що до категорії тяжких потрапляють пацієнти із супутньою патологією: ожиріння, цукровий діабет (ЦД), серцевосудинні захворювання. Проте й досі немає чітко розроблених схем інфузійної терапії у цих пацієнтів.
Яка доцільність проведення інфузійної терапії у пацієнтів із COVID-19?
За нашими спостереженнями, близько 50% пацієнтів надходять у відділення інтенсивної терапії у стані гіповолемії. Причиною цього є:
• втрата рідини при перспірації (внаслідок підвищеного потовиділення та гіпертермії);
• недостатнє вживання рідини;
• діарея;
• інше.
Усі ці фактори призводять до зневоднення організму й, у свою чергу, поглиблюють інтоксикаційний синдром, що тягне за собою збільшення в’язкості крові й, відповідно, збільшує ризики тромбоутворення.
При огляді пацієнта у стані гіповолемії наявні такі ознаки:
• сухість шкірних покривів та слизових;
• зниження тургору шкіри (у 1213% пацієнтів);
• зниження чутливості в кінцівках, особливо у верхніх; при цьому кінцівки стають холодними на дотик, з’являється мармуровість шкірних покривів як один із проявів порушення мікроциркуляції (у 15% пацієнтів).
Заслуговує на увагу проблема, що виникає при заборі крові та подальшому її дослідженні. Спостерігається таке явище, як кров по типу «желе» внаслідок підвищення її в’язкості. Це може бути предиктором розвитку тромботичних ускладнень, які потенційно можуть призвести до смерті пацієнта.
Для більш чіткого розуміння проблеми гіповолемії (дегідратації) слід згадати її клінічні ознаки.
Критерії стану гідратації відповідно до рекомендацій ВООЗ
• Еуволемія: вени заповнені, кінцівки теплі, артеріальний тиск (АТ) та частота серцевих скорочень (ЧСС) у межах норми.
• Гіперволемія: шкіра пацієнта має набряклості, відзначається яремний венозний пульс (JVP) вище норми, в анамнезі – перевантаження рідиною.
• Гіповолемія: кінцівки холодні, частота дихання >20/хв, ЧСС >90 уд./хв, олігурія та порушення свідомості.
Згідно з рекомендаціями ВООЗ, виділяють три ступеня дегідратації [4]: рання, що не має клінічних ознак; помірна; тяжка.
При помірній дегідратації у хворого є дві або більше ознак із нижче перерахованих:
• достатньо п’є рідину через спрагу;
• наявна неспокійна поведінка або роздратування;
• шкірна складка розправляється менш ніж за 2 с;
• відчуття м’якості при натисканні на очні яблука;
• язик помірно сухий;
• діурез знижений;
• кінцівки холодні.
Для тяжкої дегідратації характерно більше двох ознак із нижче перерахованих:
• погано п’є або зовсім не п’є рідину;
• відзначається патологічна сонливість або сплутаність свідомості;
• шкірна складка розправляється більш ніж за 2 с;
• глибоко запалі очі;
• сухий язик;
• відсутність сечовиділення (анурія);
• холодні, вологі й ціанотичні кінцівки;
• різка блідість шкіри тулуба;
• частий слабкий пульс одночасно з низьким АТ.
Тяжка дегідратація відповідає поняттю дегідратаційного шоку.
Клінічними ознаками, які свідчать про наявність гіповолемії та потребу в інфузійній терапії, згідно з рекомендаціями Національного інституту охорони здоров’я та вдосконалення медичної допомоги Великої Британії (NICE), є [6]:
• систолічний АТ ≤100 мм рт. ст.;
• ЧСС >90/хв;
• час капілярного наповнення >2 с або холодні на дотик кінцівки;
• частота дихання (ЧД) >20/хв;
• позитивний тест із пасивним підняттям ніг.
Тести для визначення чутливості до навантаження рідиною
Неконтрольоване введення рідини хворим у критичному стані, особливо за наявності гострого респіраторного дистрессиндрому (ГРДС), пов’язане з негативними наслідками, тому регідратація пацієнта із COVID-19 має бути належним чином керована. Вибір методу контролю адекватності проведеної інфузійної терапії під час пандемії, тобто в умовах високої завантаженості системи охорони здоров’я, викликає додаткову проблему через відносно обмежені технічні й людські ресурси.
Ідеальний тест для оцінки реакції на інфузійну терапію під час пандемії COVID-19 має бути:
• точним у пацієнтів із ГРДС;
• економічно вигідним;
• легким для інтерпретації молодшим медичним персоналом;
• дієвим для пацієнтів у положенні на животі;
• проводитися при мінімальному контакті з пацієнтом, щоб уникнути поширення інфекції.
Згідно із клінічними та інструментальними даними, ГРДС при COVID-19 може перебігати по різному й, відповідно до легеневих параметрів, поділяється на два фенотипи: L та H.
ГРДС фенотипу L характеризується:
• низькою еластичністю легень (високою піддатливістю);
• низьким співвідношенням вентиляції до кровотоку (гіпоксія пояснюється втратою регуляції перфузії та втратою механізму гіпоксичної вазоконстрикції);
• низькою вагою та низькою рекрутабельністю легень.
ГРДС фенотипу H характеризується:
• високою еластичністю легень;
• високим шунтом справа наліво (перфузія неаерованої легеневої тканини, що зумовлено її значним набряком);
• високою вагою легень та високою рекрутабельністю.
Параметри дихального об’єму та позитивного тиску наприкінці видиху здатні впливати на результати більшості тестів із визначення реакції на навантаження рідиною. Тому важливим є визначення фенотипу ГРДС у пацієнта перед застосуванням того чи іншого тесту.
Методи кардіореспіраторної взаємодії (такі, як SPV, PPV, SVV, RSVTтест) можуть застосовуватися лише у пацієнтів, які перебувають на апаратах штучної вентиляції легень та мають ГРДС фенотипу L [5, 7].
Заходи в режимі реального часу, такі як зміна пульсового тиску, більш доцільно використовувати під час цієї пандемії порівняно із заходами, отриманими за допомогою ультразвуку, оскільки використання ультразвукового апарату може сприяти поширенню інфекції.
Оцінка переднавантаження здійснюється наступними, прийнятними для використання у всіх пацієнтів із COVID-19 методами.
Стандартний тест з інфузійним навантаженням
Логічним і достовірним способом перевірити, чи відповідає пацієнт на інфузійне навантаження, є введення обмеженого об’єму, як правило, 300500 мл, рідини (510 мл/кг, при цьому, ймовірно, більш доцільно розраховувати цей об’єм на передбачену масу тіла) за 1030 хв. Проба з інфузійним навантаженням (fluid challenge) є золотим стандартом оцінки чутливості до навантаження об’ємом. Тест вважається позитивним, якщо підвищення центрального венозного тиску на 2 мм рт. ст. (тиску заклинювання в легеневій артерії – на 3 мм рт. ст.) і більше супроводжується приростом серцевого викиду на більш ніж 0,250,30 л/хв [7].
Тест із пасивним підняттям ніг
Спочатку оцінюють показники гемодинаміки пацієнта в лежачому положенні, а потім – при нахиленому на 45° ліжку. Як альтернатива, можна виконувати тест у лежачого пацієнта з пасивно піднятими до 45° ногами. Якщо через 3090 с у пацієнта з’являються ознаки гемодинамічного поліпшення, це вказує на те, що може знадобитися відновлення об’єму циркулюючої крові. Якщо стан пацієнта погіршується, зокрема з’являється задишка, це вказує на можливе перевантаження його рідиною.
Найбільш інформативним для оцінки відповіді організму на інфузію рідини після підняття кінцівок є підвищення серцевого викиду або ударного об’єму на 15%, менш цінним є підвищення АТ [5]. Якщо монітор серцевого викиду недоступний, відповідь на тест із пасивним підняттям ніг можна простежити шляхом вимірювання пульсового тиску або індексу перфузії.
Міні-рідинний тест
Враховуючи дихальну недостатність у пацієнтів із COVID-19, проведення тесту із пасивним підняттям ніг не завжди можливе, тому у цієї категорії пацієнтів більш ефективним буде мінірідинний тест з інфузійним навантаженням об’ємом 100 мл, враховуючи показники АТ, ЧСС, ЧД. Цей тест є альтернативою у пацієнтів, які знаходяться у положенні під нахилом. Його можна проводити навіть декілька разів на день.
Вибір належного тесту може залежати від рівня медичного обслуговування в країні та обсягу хворих на прийомі, який може бути надзвичайним.
Отже, наявність клінічних ознак об’ємного перевантаження, таких як набряки нижніх кінцівок, набряк легень та виражена гіпоксемія, слід розглядати поряд із показниками реакції на навантаження рідиною [5].
Якими розчинами краще коригувати гіповолемію у пацієнтів із COVID-19?
Звичайно, у першу чергу слід використовувати розчини для пероральної регідратації, але, як показує практика, пацієнти, які потрапляють до стаціонару, самостійно компенсувати гіповолемію вже не можуть (навіть при пероральному вживанні рідини в об’ємі близько 3,5 л на добу), тому потребують додаткової інфузійної терапії.
Після проведення аналізу історій хвороб пацієнтів, які перебували на лікуванні у нашому відділенні та отримували інфузійну терапію, можна констатувати, що найкращі результати спостерігались у тих, хто отримував одночасно Реосорбілакт 200 мл/добу, Ксилат 400 мл/добу, Латрен 200 мл/добу та додаткову інфузійну терапію збалансованими кристалоїдними розчинами. Загальний об’єм інфузії складав до 10001500 мл/добу. Такий об’єм був допустимий у хворих у 1-шу – 2-гу добу за наявності ознак гіповолемії та гіпертермії. Інтервал між введенням інфузійних розчинів складав до 2 год. При стабілізації температурних показників та самопочуття хворих інфузійна терапія скасовувалася.
Також слід відзначити особливу категорію пацієнтів, які, за нашими спостереженнями, потребували інфузійної терапії. Це пацієнти з підвищеним рівнем еритроцитів (>5,0×1012/л) і гемоглобіну (>150 г/л) та з нормальним або зниженим рівнем тромбоцитів. Такі показники можуть свідчити про утворення мікротромбозів внаслідок підвищеної в’язкості крові, що може призвести в подальшому до тромботичних ускладнень.
Цікавим фактом, який впливає на підбір інфузійної терапії, є те, що гостра гіперглікемія спостерігається у приблизно 50% пацієнтів, госпіталізованих у зв’язку із COVID-19, натомість як поширеність ЦД серед цієї популяції складає близько 7%. Дані також свідчать про те, що гіперглікемія у пацієнтів як із ЦД, так і без нього є важливим фактором ризику смерті від COVID-19. Добре відомо, що гостра гіперглікемія у пацієнтів відділення інтенсивної терапії є більш небезпечною за відсутності в них ЦД, ніж за наявності діабету. Гостра гіперглікемія призводить до запалення, ендотеліальної дисфункції та тромбозу через механізм оксидативного стресу. Розвиток гіперглікемії при COVID-19, вірогідно, пов’язаний із впливом SARSCoV-2 на βклітини підшлункової залози (пригнічення продукції інсуліну), що накладається на фактор наявності стресової гіперглікемії [9].
Інсулінова недостатність спричиняє істотне збільшення у крові концентрації глюкагону, який є основним контррегуляторним гормоном і відповідає за посилення глікогенолізу та ліполізу. Утилізація глюкози печінкою, м’язами та жировою тканиною за відсутності інсуліну різко знижується. У стані дефіциту інсуліну організм окислює глюкозу лише на 15%. З метою енергозабезпечення клітини переходять на окиснення вищих жирних кислот (ВЖК). Цей процес дозволяє забезпечити потребу в енергії на 75%, проте супроводжується утворенням продукту метаболізму ВЖК – кетоновими тілами (ацетон, ацетооцтова та βоксимасляна кислоти). Швидкість утворення кетонових тіл при даному стані перевищує швидкість їх утилізації та екскреції нирками. Як наслідок, розвиваються кетоз та кетоацидоз.
Крім того, розвитку кетоацидозу в пацієнтів із COVID-19 може сприяти дефіцит надходження поживних речовин у зв’язку з вираженою дихальною недостатністю, яка перешкоджає адекватному самостійному ентеральному харчуванню.
Ксилат – це комплексний поліфункціональний інфузійний препарат, який відноситься до багатокомпонентних гіперосмолярних розчинів. Основним компонентом, який зумовлює ефективність Ксилату при кетоацидозі, є ксилітол. Останній являє собою п’ятиатомний спирт, який при парентеральному введенні швидко включається в загальний метаболізм та пентозофосфатний цикл метаболізму. Вважається, що ксилітолу властива найбільша зпоміж усіх відомих речовин антикетогенна дія.
Механізм антикетогенної дії ксилітолу полягає в наступному:
• ксиліт шляхом метаболізму через пентозофосфатний цикл виступає джерелом гліцерофосфату, тим самим зменшуючи кількість вільних жирних кислот, здатних окислюватися в ацетилкофермент А (ацетилКоА);
• підвищуючи інтенсивність гліколізу, ксиліт посилює утворення піровиноградної кислоти, яка сприяє окисненню ацетилКоА у циклі Кребса;
• ксиліт посилює глікогеноутворення в печінці, що зменшує мобілізацію жиру на периферії;
• ксиліт стимулює секрецію інсуліну.
Зменшуючи рівень кетонемії, ксиліт сприяє корекції ацидозу та відновленню нормальних показників кислотнолужного балансу. Значну роль у досягненні цієї мети відіграє і другий компонент Ксилату – ацетат натрію.
Крім вищезазначеного, ксиліт є ефективним джерелом енергії. При його окисненні вивільнюється 35 молекул аденозинтрифосфату, тоді як при оксидації глюкози утворюються 32 такі молекули [5]. Біотрансформація 1 г ксиліту супроводжується виділенням 4,06 ккал. Враховуючи, що ксиліт є джерелом енергії з незалежним від інсуліну метаболізмом, його можна застосовувати як засіб для парентерального харчування [10], зокрема в умовах гіперглікемії, спричиненої інсулінорезистентністю.
За даними досліджень, було також встановлено, що ксиліт здатен збільшувати чутливість тканин до інсуліну, що потенційно може знижувати концентрацію глюкози у крові [11].
У наших пацієнтів Ксилат використовували:
• за наявності кетоацидозу;
• при кетонурії;
• при проявах метаболічного ацидозу у пацієнтів, які відмовлялись від харчування або не могли повноцінно харчуватися через виражену слабкість;
• як додаткове джерело енергії.
Реосорбілакт є унікальним гіперосмолярним кристалоїдним розчином. Важливою відмінністю препарату Реосорбілакт є поєднання як гіперосмолярних властивостей, так і властивостей збалансованих кристалоїдів (набір необхідних іонів Са2+, К+, Na+, Mg2+ в ізоплазматичній концентрації). На відміну від інших гіперосмолярних розчинів іон хлору у складі Реосорбілакту присутній в ізоплазматичній концентрації (112 проти 154 ммоль/л в ізотонічному розчині).
Завдяки гіперосмолярності Реосорбілакт спричиняє перехід рідини з міжклітинного сектора в судинне русло, що покращує мікроциркуляцію і перфузію тканин. Потужний осмодіуретичний ефект сорбітолу, пов’язаний із відсутністю в людському організмі природних механізмів реабсорбції багатоатомних спиртів у проксимальних ниркових канальцях, зумовлює виражену діуретичну й протинабрякову дію. Таке поєднання компонентів препарату та їхніх концентрацій пояснює унікальність Реосорбілакту.
Також збалансований катіонний склад сприяє відновленню електролітного складу крові. Наявність у складі натрію лактату сприяє істотному підвищенню лужного резерву карбонатного буфера плазми крові, що надзвичайно важливо для профілактики й усунення ацидозу. Сорбітол надає Реосорбілакту такі важливі властивості, як здатність відновлювати енергетичні запаси, покращувати мікроциркуляцію та перфузію тканин, стимулювати розвиток колатерального кровообігу, знижувати гіперкоагуляцію крові [8]. Цей препарат застосовувався практично у всіх пацієнтів протягом 34 діб із метою покращення реологічних властивостей крові та мікроциркуляції, а також з дезінтоксикаційною метою.
Латрен – інфузійний розчин, що містить у складі пентоксифілін (у збалансованому розчині електролітів), який гальмує агрегацію тромбоцитів та еритроцитів, підвищує їх гнучкість, зменшує концентрацію фібриногену у плазмі крові й посилює фібриноліз, що, у свою чергу, зменшує в’язкість крові та поліпшує її реологічні властивості. Крім того, пентоксифілін спричиняє слабку міотропну судинорозширювальну дію, дещо зменшує загальний периферичний судинний опір та має позитивний інотропний ефект. Унаслідок застосування пентоксифіліну покращується мікроциркуляція та постачання тканин киснем, найбільше – у кінцівках, центральній нервовій системі, помірно – у нирках. Препарат незначно розширює коронарні судини.
Латрен був ефективний при периферичному вазоспазмі, що проявлявся холодними кінцівками, мармуровістю шкіри та порушенням чутливості. Після застосування Латрену спостерігалося покращення кровообігу в кінцівках та відновлення їх чутливості. Препарат слід вводити після досягнення у хворого стану нормоволемії, дуже повільно – з метою запобігання небажаним реакціям.
Додатково до вищезазначеної інфузійної терапії пацієнти отримували збалансовані кристалоїдні розчини в об’ємі 200-400 мл, а інколи й до 1000 мл на добу.
При застосуванні описаної схеми інфузійної терапії (з обов’язковим індивідуальним підходом до пацієнта) ми не спостерігали у хворих перевантаження рідиною, натомість відзначалися:
• нормалізація рівня еритроцитів, гемоглобіну, гематокриту та фібриногену (після нормалізації даних показників у пацієнтів не виникало проблем із забором крові);
• покращення тургору й зникнення мармуровості шкіри, нормалізація температури шкіри кінцівок;
• відновлення апетиту й покращення самопочуття вже на 2-гу – 3-тю добу від початку інфузійної терапії.
Висновки
• Вибір методу оцінки чутливості до навантаження рідиною залежить від стану пацієнта, від технічного забезпечення лікувального відділення, а також від наявності достатньої кількості медичних ресурсів.
• При проведенні інфузійної терапії слід дотримуватися принципу помірної ресурситації з метою досягнення нормоволемії.
• Інфузійна терапія має бути адаптована індивідуально під пацієнта, враховувати компенсаторні можливості організму та супутні патології.
• Інфузійна терапія має бути спрямована на забезпечення адекватного серцевого викиду, покращення реологічних властивостей крові та мікроциркуляції з метою забезпечення адекватного газообміну й обміну нутрієнтами у тканинах організму.
• Вивчення методів корекції реологічних властивостей крові та мікроциркуляції як одного з додаткових методів запобігання тромботичнимусладненням у пацієнтів із COVID-19 на догоспітальному та ранньому госпітальному етапі потребує подальших досліджень.
• З огляду на широку розповсюдженість таких явищ, як інсулінорезистентність та гіперглікемія при COVID-19, доцільним є застосування 5% розчину ксилітолу (Ксилат) з метою енергозабезпечення та попередження розвитку або корекції кетозу та кетоацидозу.
Автори:
О.М. Мазур, КНП “Білоцерківська міська лікарня № 1”
Література:
- World Health Organization, https://covid19.who.int.
- Міністерство охорони здоров’я України, https://covid19.gov.ua/analitichnipanelidashbordy.
- «War to the knife» Contra la inflamación tromboinflamatoria para proteger la función endotelial de pacientes con COVID-19, https://documentcloud.adobe.com/link/track?uri=urn: aaid: scds: US:4baddb360c614e41b66400ae1049042d
- http://www.who.int/mediacentre/factsheets/fs330/en.
- Evaluation of fluid responsiveness during COVID-19 pandemic: what are the remaining choices?
- IV fluid therapy in adults in hospital: NICE guideline, May 2013.
- Кузьков В.В., Фот Е.В., Сметкин А.А., Киров М.Ю. Прогнозирование ответа на инфузионную нагрузку: от теории к практике (Clinical Anesthesiology & Intensive Care, № 1 (3), 2014.
- Ніконов В.В., Лизогуб К.І., Лизогуб М.В. Інфузійна терапія при пневмонії: що нового? // Медицина невідкладних станів. – Т. 16, № 2, 2020.
- Hyperglycemia and COVID-19: What was known and what is really new? Antonio Ceriello (diabetes research and clinical practice 167 (2020) 108383.
- Шлапак І.П., Галушко О.А. Застосування нового комплексного препарату Ксилат® при ускладненому перебігу цукрового діабету // Ліки України, травень 2007.
- Kishore P., Kehlenbrink S. Xylitol prevents NEFAinduced insulin resistance in rats.