Багатоцентрове дослідження ефективності післяопераційного знеболення в Україні з використанням парацетамолу в хірургічних стаціонарах – “РОЗУМ”
Резюме. Стаття присвячена ефективності проведення післяопераційного знеболювання в хірургічних стаціонарах України. Описано багатоцентрове дослідження ефективності післяопераційного знеболення в Україні з використанням парацетамолу в хірургічних стаціонарах – “РОЗУМ”. Визначено ефективність мультимодальної аналгезії та інших методів знеболювання в післяопераційному періоді. Виявлено предиктори виникнення неадекватного знеболювання хірургічних хворих, оцінено ризики розвитку больового синдрому у хірургічному стаціонарі. Проведено оцінку використання парацетамолу в схемах мультимодальної аналгезії в післяопераційному періоді.
Ключові слова: Парацетамол, аналгезія, післяопераційний період, мультимодальна анальгезія.
Вступ
Як це нерідко буває в медицині, історія відкриття парацетамолу (П) пов’язана з випадковим збігом обставин. У 1893 році по помилці фармацевта хворому з хронічним больовим синдромом до складу ліків потрапила стороння хімічна сполука – ацетанілід. На щастя, пацієнт не тільки не постраждав, але й відзначив виражене зменшення болю. Подальші дослідження ацетаніліду показали, що ця речовина є досить сильним анальгетиком, але навіть у помірних терапевтичних дозах призводить до важкого токсичного пошкодження печінки [1].
В подальшому було зроблено енергійні спроби синтезувати новий анальгетик, що базується на хімічній структурі ацетаніліду, але має меншу токсичність. Невдовзі з’явився новий препарат, який в Англії називається “парацетамол” (від параацетил-амінофенол), а в США – “ацетамінофен”[1].
Справжнє визнання та широкий попит Парацетамолу настали через пів віку – після того, як у Великобританії була розроблена технологія промислового виробництва високоочищеного препарату [2]. Початок масового виробництва Парацетамолу спровокував високий попит населення на препарат, що одночасно володіє вираженим протибольовим і жарознижуючим ефектом, при мінімумі побічних дій.
Як виявилось, Парацетамол дуже добре відповідає даним вимогам. У 1995 році експерти ВОЗ провели порівяльну оцінку препаратів різних груп із сукупною анальгетичною й антипіретичною дією. За критеріями “ефективності/безпечність” перше місце отримав Парацетамол [1]. Серед анальгетиків-антипіретиків Парацетамол залишається лідером продажу навіть через 100 років від моменту свого першого клінічного використання і майже 60 років – після широкого виходу на ринок.
Нині Парацетамол випускається в різних країнах і під різними назвами. Для знеболення в післяопераційному періоді використовують парентеральні форми в розчині для інфузій (Інфулган, Іфімол, Параморф, Блімол, Анапірон).
Деякі відомості про можливі механізми терапевтичної дії парацетамолу
Не дивлячись на довготривалу історію клінічного використання і хорошу вивченість терапевтичних ефектів, механізм дії Парацетамолу до сьогодні залишається недосить зрозумілим.
До початку 70-х рр ХХ ст. не викликало сумнівів, що Парацетамол володіє переважно центральним механізмом дії [3–5], і те, що анальгетичний ефект Парацетамолу до певного ступеня пропорційний як разовій, так і добовій ( сумарній ) дозі препарату [6].
Певний прорив у розумінні механізмів дії ненаркотичних анальгетиків настав близько 35 років тому, коли було показано, що більшість НПЗП реалізує терапевтичну дію за рахунок пригнічення синтезу простагландинів. Як виявилося, ключову роль відіграє можливість впливу НПЗП на фермент циклооксигеназу (ЦОГ, або простагландин-Н2-синтетаза [7]. Через 10 років дане відкриття принесло Джону Вейну Нобелівську премію в медицині.
Ще через 10 років стало очевидним, що існує по крайній мірі дві ізоформи ЦОГ, відповідно названі ЦОГ-1 та ЦОГ-2 [8]. Більшість відомих на сьогодні НПЗП одночасно блокують ЦОГ-1 та ЦОГ-2 [9]. Існує точка зору, яка підтримує наявність селективності препаратів у відношенні цих ферментів. Вона, безумовно, має право на існування, але ще потребує детально побудованих доказів. Деякі дослідження, що виконані в останні роки, дозволяють допустити існування ще одного представника сімейства ЦОГ – ЦОГ-3 [10, 11].
Виявилося, що Парацетамол – дуже слабкий інгібітор як ЦОГ-1, так і ЦОГ-2, хоча його клінічне використання супроводжується досить вираженим анальгетичним і антипіричним ефектом порівняно з іншими препаратами [1,2]. Дана обставина внесла додаткові параметри в розуміння механізмів дії Парацетамолу, що дозволило пояснити практично повну відсутність у препарату протизапального ефекту (протизапальна дія багатьох препаратів реалізується через інгібування ЦОГ-2).
В остані роки було висловлено два припущення про механізми дії Парацетамолу. Graham et al. [13] погоджуються, що препарат практично не показує вплив in vitro на ферменти ЦОГ-1 та ЦОГ-2, але вважають, що Парацемол може блокувати in vitro біологічні ефекти простагландинів в інтактних клітинах за рахунок прямого зменшення концентрації арахідонової кислоти. Можливо, вплив Парацетамолу на синтез простагландинів реалізується через регуляцію стимулюючої дії на цей процес протизапальних цитокінів [13].
На думку інших дослідників, Парацетамол є специфічним і єдиним інгібітором гіпотетичної ЦОГ-3 [2]. Допускається також, що роль ЦОГ-3 реалізується на порівняно пізніх стадіях запального процесу опосередковано через вплив на синтез ендрогенних протизапальних медіаторів [14, 15]. Дія Парацетамолу також може бути пов’язана з центральним механізмом, що відрізняється від інгібування синтезу простагландинів (табл. 1).
Таблиця 1. Основні властивості різних типів ЦОГ

Використання парацетамолу у лікуванні гострого і хронічного болю
“Primum non nocere” – основний принцип медицини, і про його актуальність під час вибору знеболювального засобу має пам’ятати кожен практикуючий лікар, адже нестероїдні протизапальні препарати (НПЗП), які в більшості випадків є препаратами першої лінії для зняття болю, мають низку негативних властивостей, зумовлених пригніченням активності протективної циклооксигенази-1 (ЦОГ-1). Одним із найчастіших побічних ефектів НПЗП є гастродуоденальна токсичність, яка виникає внаслідок пригнічення основних факторів захисту: простагландинів (ПГ) та оксиду азоту.
Згідно з рекомендаціями, що базуються на даних доказової медицини, первинна профілактика гастроінтестинальної токсичності НПЗП має включати:
• вибір НПЗП з меншою гастротоксичністю або специфічних інгібіторів ЦОГ-2;
• застосування інгібіторів протонної помпи (ІПП). Перевагу слід віддавати пантопразолу, який втричі зменшує ризик повторної кровотечі порівняно з омепразолом і має кращий профіль безпеки за рахунок мінімального впливу на цитохром Р450 та відсутність необхідності в корекції дози у пацієнтів похилого віку з порушеною функцією нирок;
• застосування Н-2-блокаторів гістаміну;
• застосування мізопростолу.
Специфічні інгібітори ЦОГ-2, хоч і мають переваги перед рештою НПЗП, будучи ефективними знеболювальними й викликаючи менше несприятливих гастроінтестинальних подій, однак здатні також негативно впливати на пацієнтів з високим кардіоваскулярним ризиком, а комбінація неселективних НПЗП з ІПП ефективніша у профілактиці ускладнень з боку шлунково-кишкового тракту (ШКТ), ніж коксиби у вигляді монотерапії. Результати сучасних міжнародних досліджень стосовно впливу неселективних НПЗП на ризик гастроінтестинальних ускладнень представлені в таблицях 2, 3.
З точки зору співвідношення профілю “ефективність/ безпека” привертає до себе увагу ацетамінофен (парацетамол), ін’єкційна форма якого представлена на ринку України компанією “Юрія-Фарм” під торговельною назвою Інфулган. Дуже важливо, що доведеною є безпечність використання Інфулгану в добовій дозі 4000 мг.
Як показали дослідження високого ступеня доказовості, ацетамінофен у дозі 1000 мг зіставний за аналгетичним ефектом із кеторолаком (30 мг), диклофенаком (75 мг), метамізолом (2500 мг) та морфіном (10 мг). У випадку Інфулгану внутрішньовенне введення 1000 мг препарату можна призначати 4 рази на добу.
Дослідження G. Amo та співавт., яке полягало у вивченні генів, що впливають на метаболізм гістаміну, виявило, що серед 314 пацієнтів із проявами побічних реакцій ацетамінофен викликав у 5 разів менше реакцій гіперчутливості, ніж анальгін.
Таблиця 2. Відносний ризик виникнення гастроінтестинальних ускладнень при застосуванні коксибів і традиційних НПЗП
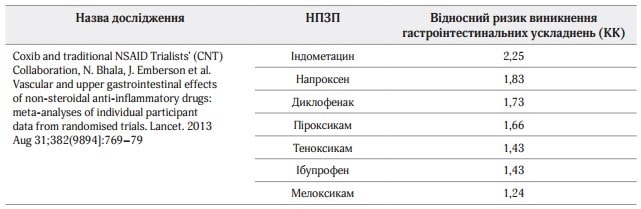
Таблиця 3. Відносний ризик виникнення гастроінтестинальних ускладнень при застосуванні НПЗП
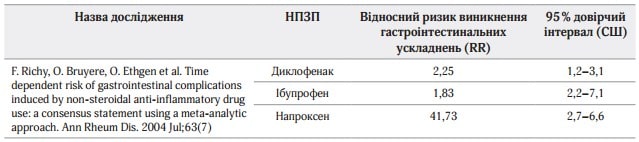
Згідно з результатами Кокранівського систематичного огляду, парацетамол є ефективним аналгетиком для лікування гострого болю, а частоту випадків побічних реакцій можна порівняти з такою у плацебо. Внутрішньовенне його введення передта інтраопераційно зменшує частоту виникнення епізодів нудоти та блювання в післяопераційному періоді (клас рекомендацій І).
У випадку, якщо необхідний знеболювальний ефект не досягнутий, слід розглянути можливість застосування опіоїдних аналгетиків. Одним із представників цієї групи є препарат Налбуфін, який відноситься до агоністів-антагоністів опіатних рецепторів (є агоністом-рецепторів і антагоністом μ-рецепторів), що, у свою чергу, порушує міжнейронну передачу больових імпульсів на різних рівнях центральної нервової системи, впливаючи на вищі відділи головного мозку. Препарат гальмує умовні рефлекси, чинить седативну дію, спричиняє дисфорію, міоз, збуджує блювальний центр.
Використання парацетамолу при оперативних втручаннях
На сьогодні найновіший підхід у проведенні малоінвазивних оперативних втручань полягає у використанні методики Fast-Track Surgery (“хірургія швидкого шляху”, прискорення різних етапів лікувального процесу), або Enhanced Recovery After Surgery – ERAS (прискорення відновлення після хірургічних операцій), піонером якої в Європі став проф. H. Kehlet. ERАS дозволяє зменшити тривалість лікування більш ніж на 30 %, а кількість післяопераційних ускладнень – більш ніж на 50 %. Fast-Track Surgery, яка являє собою систему поглибленої підготовки пацієнта в передопераційному періоді в поєднанні з системою активної післяопераційної реабілітації, включає наступне:
• створення комп’ютерних операційних;
• відмову від традиційних методів відновлення цілісності тканин, таких як заміна зшивання на степлерну технологію;
• відмова від рутинного використання дренажів та зондів;
• раннє видалення сечового катетера;
• застосування прокінетиків;
• відмова від передопераційної підготовки кишечника;
• ранній початок прийому їжі;
• рання мобілізація, профілактика венозної тромбоемболії;
• оптимальний контроль болю, оскільки мінімальна травма передньої черевної стінки не звільняє пацієнтів від післяопераційного болю, через подразнення очеревини вугільною кислотою.
Рекомендація 6
Рекомендується застосовувати мультимодальну аналгезію, тобто сумісне використання різних аналгетиків та методів знеболення у поєднанні з нефармакологічними методами лікування післяопераційного болю у дорослих та дітей (сильна рекомендація, високий рівень доказовості).
Рис. 1. “Піраміда” мультимодальної аналгезії
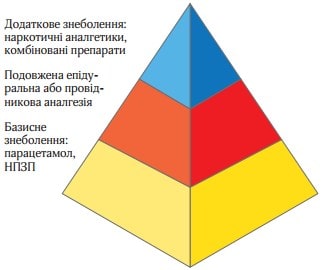
Анестезія має забезпечувати безпеку пацієнта та швидке відновлення в післяопераційному періоді. Для цього застосовується збалансована мультимодальна аналгезія (рис. 1), яка передбачає одночасне застосування двох і більше аналгетиків, що дозволяє досягнути адекватного знеболення при мінімумі побічних ефектів, характерних при призначенні великих доз одного аналгетика в режимі монотерапії.
Основні принципи інтраопераційної стратегії при Fast-Track-хірургії включають наступне:
• відмова від проведення премедикації;
• індукція анестезії 1 % розчином пропофолу;
• на етапі підтримання анестезії використовується інгаляційний анестетик севофлуран (поток свіжої газової суміші 1 л/хв);
• аналгезія 0,005 % розчином фентанілу в дозі 1–2 мкг/кг/год;
• після індукції анестезії вводиться 50 мг декскетопрофену;
• перед екстубацією вводиться Інфулган 1000 мг внутрішньовенно;
• інфільтрація хірургом шкіри в місцях розрізу розчином місцевого анестетику (Лонгокаїн 0,25 %).
Препаратом вибору для базисного знеболення є парацетамол (Інфулган), механізм дії якого відкритий у 1971 р. англійським фармакологом J. R. Vane.
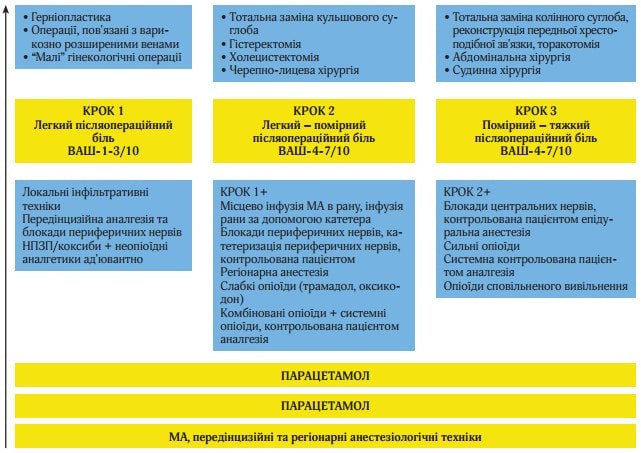
Основні принципи ступінчатої ММА в післяопераційному періоді відображені на рисунку 2.
Відповідно до настанови Американської асоціації з лікування післяопераційного болю рекомендується призначення парацетамолу й/або НПЗП у дорослих та дітей у якості складової ММА (клас рекомендацій І, рівень доказовості високий). Комбіноване використання парацетамолу та НПЗП забезпечує краще знеболення, ніж кожен препарат окремо.
Матеріали та методи
Дизайн дослідження. В цілому в дослідження було включено 400 пацієнтів. Дослідження проводилися у 20 центрах України (з розрахунку один дослідник на один медичний центр) і були включені в багатоцентрове постмаркетингове дослідження з оцінки знеболюючої ефективності ацетамінофену в схемі ММА.
Пацієнтам виконували наступні хірургічні втручання: абдомінальні оперативні втручання (холецистектомія, апендектомія, кишкова непрохідність), з приводу переломів шийки стегна, переломів різних зон) та інші. У дослідження включали пацієнтів, які перебували в післяопераційному періоді, у віці 19–67 років, обох статей, які відповідали виділеним критеріям включення: пацієнти не повинні були приймати будь-які знеболюючі засоби або транквілізатори за 6 год до початку дослідження. Про кожного пацієнта були зібрані демографічні дані, медичний анамнез.
Початкове оцінювання інтенсивності болю виконували в спокої і при кашлі, у різні години після хірургічної операції. В ході роботи ми бачилися з пацієнтами спочатку під час їх консультації з приводу майбутнього хірургічного втручання і обговорення можливості включення в дослідження, а потім після хірургічного втручання для спостереження за ними в післяопераційному періоді. Після операції записували дані про тяжкість болю та його ослаблення спочатку – до прийому препаратів – і через 6, 12 і 24 год. Всі прийняті знеболювальні препарати враховували відповідно до їх виду і часу прийому та механізму дії.
Рис. 2. Основні принципи ступінчастої мультимодальної аналгезії в післяопераційному періоді
Критерії ефективності та безпеки
Пацієнти оцінювали і записували інтенсивність післяопераційного болю до прийняття знеболюючих препаратів (вихідні умови, або “час 0”) і через 30 хв, 6, 12, 24, 48, 72 год після оперативного втручання. Інтенсивність болю записували за допомогою візуально-аналогової шкали, де інтенсивність болю оцінювали від 0 – немає болю і до 10 – максимально виражений больовий синдром. Всі інші показники, що відображають ефективність, були розраховані як похідні вищенаведених даних. До них відносять показник, що розраховується для кожної точки часу, – різниця в інтенсивності болю (РІБ) і показники, що підсумовують зміни під час усього періоду дослідження – 4 і 6 год, зважені суми різниць в інтенсивності болю (СРІБ) і максимальну різницю в інтенсивності болю (МРІБ), що досягається до 6 год спостереження.
Ослаблення післяопераційного болю пацієнти оцінювали через 30 хв, 6, 12, 24, 48, 72 год після початку знеболювання і записували його в балах: 1 – повне ослаблення, 2 – ослаблення наполовину, 3 – ослаблення менш ніж наполовину, 4 – немає ослаблення. Для зручності подальшого аналізу цю шкалу трансформували таким чином, щоб більший бал відповідав більшому ослабленню болю (4 – повне ослаблення болю і т.д.). Величина ослаблення болю, записана в балах для кожної з точок часу, представлена порядковою шкалою.
Загальне ослаблення болю (ЗОБ) є сумарним показником, що розраховується як зважена сума величин ослаблення болю в кожній з точок часу. І хоча шкала вимірювання ослаблення болю відрізняється від тієї, яка використовувалася в інших дослідженнях, ООБ відповідає традиційному показнику “площа під кривою ослаблення болю”, що наводиться в літературі. ЗОБ та СРІБ є інтегральними показниками величини загального ослаблення болю до 4 і 6 год дослідження. Для того щоб оцінити безпеку проведеного лікування, пацієнти реєстрували тип, інтенсивність і тривалість будь-якого ускладнення, які виникають в ході проведення знеболювання.
Статистичний аналіз. Дані, отримані в дослідницьких центрах, були об’єднані після статистичної перевірки на можливість їх злиття. Тому результати статистичного аналізу, представлені в дослідженні, отримані головним чином на всіх хворих, з поправками на можливі впливи з боку дослідників. В окремих аналізах оцінили однорідність пацієнтів у кожній з виділених груп до початку дослідження, а також ефективність і безпеку проведеного лікування. У всіх випадках застосовували точний критерій Фішера для таблиць 2-4. Первинну ефективність лікування оцінювали за інтенсивністю болю та ослабленням болю. Ці показники були виражені порядковою шкалою і тому були проаналізовані за допомогою непараметричних процедур.
Для того щоб статистично оцінити можливість об’єднання даних про ефективність лікування, отриманих в різних медичних центрах, а також для вивчення цих даних стосовно кожного центру окремо, були розраховані ключові показники ефективності – СРІБ і ООБ – для кожного окремо взятого медичного центру. При цьому в межах одного центру різні групи хворих порівнювали за допомогою t-критерію Стьюдента для незалежних вибірок. Всі статистичні порівняння виконували як двосторонні. При цьому був використаний пакет статистичних програм Statistical Analysis System.
Результати
Із 404 пацієнтів, включених у дослідження, 144 отримували парацетамол у складі мультимодального знеболювання, 132 – опіоїдні анальгетики та 124 пацієнти отримували знеболення за схемою НПЗП + опіоїди. Чотири пацієнти були виключені з аналізу. При аналізі ефективності враховували тільки ті дані, які були отримані у повній мірі і дають змогу провести статистичний аналіз отриманних даних. Таким чином, 400 пацієнтів були включені в аналіз ефективності знеболення. Як випливає з таблиці 4, середній вік пацієнтів дослідження склав 47 років (47,4 ± 11,3), з них чоловіків було приблизно 44 %.
Ефективність
Частота прийому додаткового препарату є першим показником порівняльної ефективності лікування. В цілому порівняно з іншими дослідженнями післяопераційного болю в нашому дослідженні відзначено вищу частоту прийому додаткового препарату у пацієнтів, де використовувалися тільки опіоїдні анальгетики. Всі відмінності були статистично значущими: для групи ММА р-значення менше 0,001 порівняно з пацієнтами, яким використовувалися для знеболювання опіоїдні анальгетики.
Таблиця 4. Демографічна характеристика у пацієнтів, які включені в аналіз ефективності
Оцінка ефективності в кожній точці часу
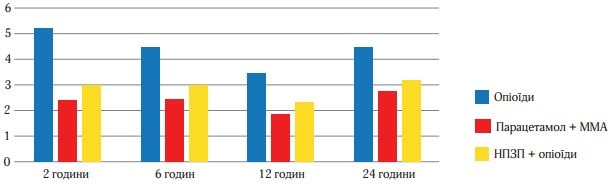
Інтенсивність болю в початкових умовах через 1/2, 1, 2, 3, 4, 5 і 6 год щодо вихідних значень представлені на рисунку 3. Ці дані відображають однорідність виділених груп на початку лікування і свідчать про більшу клінічну ефективність Парацетамолу (Інфулгану) + ММА порівняно з опіоїдами та НПЗП +опіоїди щодо зниження інтенсивності післяопераційного болю в ході нашого дослідження. Статистично значуща перевага Парацетамолу + ММА відзначалася вже через 2 години після початку лікування і зберігалася до 6 год спостереження. При цьому всі порівняння давали р-значення менше 0,001. Найбільша різниця в значеннях спостерігалася між 3 і 6 год. В той же час обидва види активної терапії були достовірно гірші порівняно з ММА у всіх точках часу.
Рис. 3. Інтенсивність болю в часовому вимірі за шкалою ВАШ за першу добу
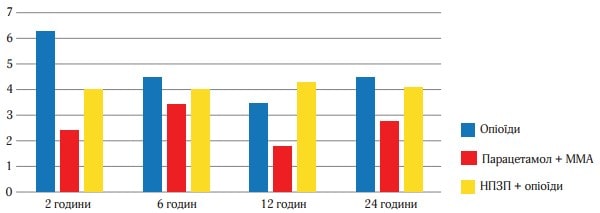
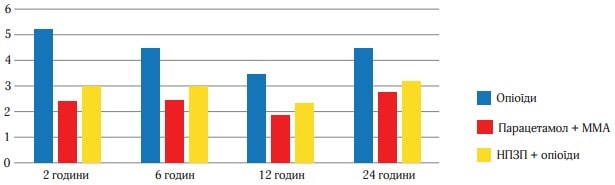
Рисунок 4 (середня величина ослаблення болю на другу добу) і рисунок 5 (відсоток пацієнтів, у яких біль ослаб більш ніж наполовину) відображають дані про ослаблення болю в кожен момент часу. Обидва малюнки свідчать про більшу ефективність ММА, їх патерн подібний до того, який було отримано при вивченні РІБ. Р-значення, отримані при парному порівнянні даних, підсумованих на рисунках 4 і 5, багато в чому подібні до тих, що представлені в таблиці 2. Статистично хороша ефективність ММА щодо показників ослаблення болю спостерігалася в ті самі точки часу, щодо показника тяжкості болю за шкалою ВАШ. Найбільш виражена різниця між значеннями, отриманими у виділених групах лікування, спостерігалася на 3-й і 4-й год. Наприклад, до 3 год частка пацієнтів, які повідомили про ослаблення болю більш ніж наполовину, склала 73 % в групі Парацетамол (Інфулган) + ММА, 58 % в групі НПЗП + опіоїди і 27 % в групі опіоїдів (рисунок 6).
Рис. 4. Інтенсивність болю в часовому вимірі за шкалою ВАШ за другу добу
Сумарні показники ефективності лікування
На рисунку 4 представлено узагальнені показники інтенсивності болю та ослаблення болю за весь час дослідження, включаючи СРІБ і 3ОБ до 4 і 6 год. Усі порівняння, представлені в табл. 3, є статистично достовірними і свідчать про більшу ефективність Парацетамол (Інфулган) + ММА порівняно з групою НПЗП + опіоїди і опіоїдами. Наприклад, середнє значення СРІБ до кінця 4-ї год спостереження в групі НПЗП + опіоїди склало 4,32, в групі Парацетамол + ММА – 3,27, в групі опі-оїдів – 4,99. Значення СРІБ до 4 і 6 год спостереження статистично значимо різняться в групах активного лікування порівняно з опіоїдами і в групі НПЗП + опіоїди порівняно з Парацетамолом (Інфулганом)+ ММА (p-значення менше 0,001 у всіх випадках).
Ослаблення болю в кожному з медичних центрів
Додаткові дані, що свідчать про ефективність лікування, були вивчені при оцінці порівнянності результатів, отриманих в різних медичних центрах.
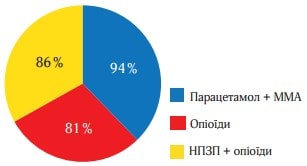
На рисунку 7 представлено значення ЗОБ до 6 год спостереження, розраховані окремо для кожного з центрів дослідження. При порівнянні за цим показником груп хворих, які отримували активне лікування, в 6 із 7 медичних центрів було виявлено велику ефективність Парацетамол + ММА порівняно з опіоїдами. У всіх випадках, коли між групами лікування в тому чи іншому центрі виявляли достовірні відмінності, відзначалося переважання Парацетамол + ММА. Так, у дослідницьких центрах № 3, 5 і 7 було відзначено вищу активність ММА порівняно з ацетамінофеном і опіоїдами (р-значення менше 0,050).
Рис. 5. Відсоток пацієнтів, у яких біль ослаб більше ніж наполовину
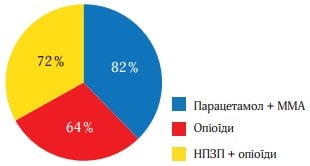
Рис. 6. Середній рівень інтенсивності болю (СРІБ)
Тільки в дослідному центрі № 2 було відзначено вищу ефективність опіоїдів порівняно з ММА. Однак ці відмінності не були статистично значущими (р = 0,704) і були отримані в центрі з найменшою кількістю пацієнтів (n = 16). Аналогічні результати були отримані й щодо інтенсивності болю. Порівнянність даних про ефективність лікування, отриманих у кожному окремо взятому дослідному центрі, слугує статистичним підтвердженням можливості їх об’єднання при проведенні загального аналізу [31, 35]. Отже, слід визнати валідними результати, отримані в ході нашого дослідження.
Рис. 7. Ослаблення болю в кожному з медичних центрів залежно від схеми знеболення
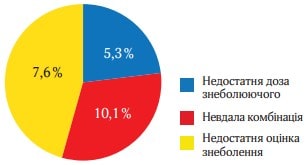
Дані про небажані схеми лікування підсумовані на рисунку 8.
У ньому представлені загальна частота помилок або небажанних схем знеболення (помилкових) у ході дослідження. Найчастішим типом неправильного знеболення було призначення недостатньої дози парацетамолу (7,2 %) та невдала комбінація лікарських засобів, наприклад, морфін + налбуфін (5,4 %) (рис. 8).
Рис. 8. Найбільш поширені небажані схеми в знеболенні
Обговорення
У цьому клінічному дослідженні порівнювали ефективність Парацетамолу +ММА, НПЗП + опіоїди та опіоїдів у лікуванні болю, пов’язаного з хірургічними втручаннями. Біль, який відчуває пацієнт, є, як правило, різної інтенсивності, що вимагає призначення препаратів та схем, здатних боротися з помірним та інтенсивним болем. Станом на сьогодні парацетамол залишається найчастіше вживаними препаратом для знеболення з добовою дозою до 4000 мг [4]. Для збільшення ефективності даних препаратів їх часто комбінують з центрально діючими опіатними анальгетиками, такими як кодеїн або гідрокодон. Останні, хоч і мають адитивну дію, також помітно збільшують частоту побічних ефектів [20].
Результати даного багатоцентрового подвійного дослідження – Багатоцентрове дослідження ефективності післяопераційного знеболення в Україні з використанням Парацетамолу в хірургічних стаціонарах – “РОЗУМ”.
Чутливість обраної моделі болю підтверджується тим фактом, що обидва види активного лікування були достовірно ефективніші, ніж опіоїдів. При оцінці показників тяжкості й ослаблення болю в кожній із точок часу, так само як і при оцінці сумарних 4 і 6 год показників, ефективність схеми Парацетамолу+ММА чітко перевищувала показники у групах опіоїдів та НПЗП+опіоїди. Парацетамол у складі ММА переносився добре. Частота ускладнень у трьох групах склала 10, 10 і 14 % відповідно. Найчастіше спостерігалися побічні ефекти з боку шлунково-кишкового тракту; їх частота була однаковою при всіх трьох видах терапії.
При виконанні цього дослідження в кожному з 20 медичних центрів були задіяні спеціально навчені медсестри. Валідність отриманих результатів пов’язана з великою кількістю чинників. Найважливішим з них є той факт, що всі медичні сестри були спеціально навчені і перебували під управлінням однієї науководослідної групи. Ми об’єднали дані, отримані в різних медичних центрах, оскільки, незважаючи на географічне розділення місць дослідження, в кожному з них за основу було взято один і той же протокол дослідження і однакову структуру проведення дослідження.
Можливість об’єднання даних була також підтверджена статистично, оскільки показники ефективності, зареєстровані в різних дослідницьких центрах, були узгоджені між собою. Порівнянність і поєднуваність даних, отриманих у семи дослідних центрах, є хорошим аргументом на користь того, що дані цього дослідження можуть бути поширені на загальну популяцію всіх пацієнтів, що піддаються вищезгаданим видам оперативних втручань.
Висновок
Парацетамол (Інфулган) для післяопераційного знеболення може з успіхом використовуватися в практичній роботі відділень ІТ та профільних хірургічних відділеннях при різних інтенсиностях больового синдрому, а безпечною добовою дозою є 4 грами і тривалість використання до повного купірування больового синдрому. Даний препарат володіє власним достатньо вираженим знеболюючим ефектом. А його використання в схемі ММА як базового компонента дає достатній ефект у лікуванні больових відчуттів у ранньому післяопераційному періоді.
Преемптив-аналгезія з Парацетамолом (Інфулганом) за 30 хв до операції сприяє:
• стабільнішому рівню знеболення;
• зниженню загальної дози опіоїдних анальгетиків;
• менш вираженій стрес-реакції;
• меншій інтенсивності болю в ранньому післяопераційному періоді;
• зниженню дози опіоїдів у 1-шу добу після операції (зниження потреби в морфіні на 46 %, що дозволяє зменшити дозозалежні побічні ефекти опіоїдів).
Автори:
Дмитрієв Д. В., Фелештинський Я. П., Василюк С. М., Шапринський В. О., Деркач Ю. П., Лапшин Д. В., Комарчук В. В., Хвисюк А. М., Вовк В. М., Безкоровайний В. І., Юрків В. Ю., Лоскуток О. Є., Василевська Л. А., Мартинюк В. О., Куновський В. В., Дейкало І. М., Шкварковський І. В.
ВНМУ ім. М. І. Пирогова
МКЛ № 5 м. Київ, МКЛ № 1, м. Івано-Франківськ, Обласна клінічна лікарня ім. М. І. Пирогова, м.Вінниця, ОЛБ, Харків,
ЛШМД, Харків,
Обласна клінічна травматологічна лікарня, Харків, ОКЛ, Харків. ХНІОНХ, Харків, КОКЛ м. Київ,
Одеський національний медичний університет, Одеса, МКЛ №11, Київ, МКЛ №1, Київ,
Клініка Святого Миколая, Одеса,
ГУ Дніпропетровська медична академія МОЗ України, КУ Обласна клінічна лікарня ім. І.І. Мечникова, Дніпро, ЛШМД м. Львів,
ЛШМД м.Тернопіль
Література:
- Beecher HK. Experimental Pharmacology and MeasureBeech- er HK. Experimental Pharmacology and Measurement of the Subjective Response. Science [Internet]. American Asso- ciation for the Advancement of Science (AAAS); 1952 Aug 15;116(3007):157–62. Available from: https://doi.org/10.1126/ science.116.3007.157
- Beecher HK. The measurement of pain: prototype for the quantitative study of subjective responses. Pharmacological reviews. 1957 Mar 1;9(1):59-209.
- Beecher HK. Measurement of subjective responses: quantita- tive effects of drugs.
- Mehlisch DR. Review of the comparative analgesic efficacy of sa- licylates, acetaminophen, and pyrazolones. The American Jour- nal of Medicine [Internet]. Elsevier BV; 1983 Nov;75(5):47–52. Available from: https://doorg/10.1016/0002-9343(83)90232-2
- VANE JR. Inhibition of Prostaglandin Synthesis as a Mecha- nism of Action for Aspirin-like Drugs. Nature New Biology [Internet]. Springer Science and Business Media LLC; 1971 Jun;231(25):232–5. Available from: https://doi.org/10.1038/ newbio231232a0
- Hart FD, Huskisson EC. Non-Steroidal Anti-Inflammatory Drugs. Drugs [Internet]. Springer Science and Business Me- dia LLC; 1984 Mar;27(3):232–55. Available from: https://doi. org/10.2165/00003495-198427030-00004
- O’Brien WM. Pharmacology of nonsteroidal anti-inflamma- tory drugs. The American Journal of Medicine [Internet]. El- sevier BV; 1983 Oct;75(4):32–9. Available from: https://doi. org/10.1016/0002-9343(83)90326-1
- Castles JJ, JJ C, JL S. Comparative efficacy and safety of naprox- en and ibuprofen in rheumatoid arthritis.
- Davies EF, Avery GS. Ibuprofen. Drugs [Internet]. Springer Science and Business Media LLC; 1971;2(5):416–46. Available from: https://doorg/10.2165/00003495-197102050-00002
- Giansiracusa JE, Donaldson MS, Koonce ML, Lefton TE, Ruoff GE, Brooks CD. Section 1 Ibuprofen in osteoarthriti Current Medical Research and Opinion [Internet]. Informa Healthcare; 1975 Jan;3(8):481–4. Available from: https://doi. org/10.1185/03007997509110578
- Lanza FL. Endoscopic Studies of Gastric and Duodenal Injury after the Use of Ibuprofen, Aspirin, and Other Nonsteroidal Anti-Inflammatory Agents. The American Journal of Medi- cine [Internet]. Elsevier BV; 1984 Jul;77(1):19–24. Available from: https://doorg/10.1016/s0002-9343(84)80014-5
- OWEN-SMITH BD, BURRY HC. IBUPROFEN IN THE MANAGEMENT OF OSTEOARTHROSIS OF THE HIP. Rheumatology [Internet]. Oxford University Press (OUP); 1972;11(6):281–6. Available from: https://doi.org/10.1093/ rheumatology/11.6.281
- Ruoff G, RL P. Aspirin-acetaminophen vs ibuprofen in a con- trolled multicenter double-blind study with patients experi- encing pain associated with osteoarthritis.
- Shapiro SS, SS S. The effect of ibuprofen in the treatment of dysmenorrhea.
- Corson SL, Bolognese RJ. Ibuprofen therapy for dysmen- orrhea. The Journal of reproductive medicine. 1978 May 1;20(5):246-52.
- MILSOM I, ANDERSCH B. Effect of ibuprofen, naproxen so- dium and paracetamol on intrauterine pressure and menstru- al pain in dysmenorrhoea. BJOG: An International Journal of Obstetrics & Gynaecology. 1984 Nov;91(11):1129-35.
- Bourne MS. The effect on healing of analgesic and anti-in- flammatory therapy. British journal of sports medicine. 1980 Mar;14(1):26.
- MUCKLE DS. Comparative study of ibuprofen and aspirin in soft-tissue injuries. Rheumatology [Internet]. Oxford Univer- sity Press (OUP); 1974;13(3):141–7. Available from: https:// doi.org/10.1093/rheumatology/13.3.141
- Cooper SA, PECHEUR H, Rauch D, Rosenheck A, Ladov M, ENGEL J. The analgesic efficacy of ibuprofen compared to acetaminophen with codeine. InJOURNAL OF DENTAL RE- SEARCH 1984 Jan 1 (Vol. 63, pp. 311-311). 1619 DUKE ST, AL- EXANDRIA, VA 22314: AMER ASSOC DENTAL RESEARCH.
- Beaver WT, Forbes JA, Barkaszi BA, Ragland RN, Hankle JJ. An evaluation of ibuprofen and acetaminophen in postoper- ative oral-surgery pain. Inclinical pharmacology & therapeu- tics 1987 Feb 1 (Vol. 41, No. 2, pp. 180-180). 11830 WEST- LINE INDUSTRIAL DR, ST LOUIS, MO 63146-3318: MOS- BY-YEAR BOOK INC.
- Cooper SA. Five Studies on Ibuprofen for Postsurgical Den- tal Pain. The American Journal of Medicine [Internet]. El- sevier BV; 1984 Jul;77(1):70–7. Available from: https://doi. org/10.1016/s0002-9343(84)80022-4
- Winter L, JG P. A double-blind, comparative evaluation of acetaminophen, caffeine, and the combination of acetamin- ophen and caffeine in outpatients with post-operative oral surgery pain.
- Statistical Aspects of the Analysis of Data From Retrospective Studies of Disease. JNCI: Journal of the National Cancer In- stitute [Internet]. Oxford University Press (OUP); 1959 Apr; Available from: https://doi.org/10.1093/jnci/22.4.719
- Armitage P, Berry G, Matthews JN. Statistical methods in medical research. John Wiley & Sons; 2008 Apr 15.
- Van Elteren PH. On the combination of independent two sam- ple tests of Wilcoxon. Bull Inst Intern Staist. 1960;37:351-61.
- Neter J, Wasserman W, Kutner MH. Applied Linear Statistical Models (Homewood, IL: Irwin). NeterApplied Linear Statis- tical Models1985.
- SAS R. NC. SAS User’s Guide: Statistics. Cary, NC.
- DIONNE RA, CAMPBELL RA, COOPER SA, HALL DL, BUCKINGHAM B. Suppression of postoperative pain by preoperative administration of ibuprofen in comparison to placebo, acetaminophen, and acetaminophen plus codeine. The Journal of Clinical Pharmacology. 1983 Jan;23(1):37-43.
- KANTOR TG. Ibuprofen. Annals of Internal Medicine [Inter- net]. American College of Physicians; 1979 Dec 1;91(6):877. Available from: https://doi.org/10.7326/0003-4819-91-6-877
- Busson M. Update on Ibuprofen: Review Article. Journal of International Medical Research [Internet]. SAGE Publica- tions; 1986 Mar;14(2):53–62. Available from: https://doi. org/10.1177/030006058601400201
- Miller RR. Evaluation of the Analgesic Efficacy of Ibupro Pharmacotherapy: The Journal of Human Pharmacology and Drug Therapy [Internet]. Wiley; 1981 Jul 8;1(1):21–7. Available from: https://doi.org/10.1002/j.1875-9114.1981.tb03550.x
- Laska EM, Sunshine A, Marrero I, Olson N, Siegel C, Mc- Cormick N. The correlation between blood levels of ibupro- fen and clinical analgesic response. Clinical Pharmacology and Therapeutics [Internet]. Springer Science and Business Media LLC; 1986 Jul;40(1):1–7. Available from: https://doi. org/10.1038/clp1986.129
- Dmytriiev D. Assessment and treatment of postoperative pain in children. Anaesthesia, Pain & Intensive Care. 2019 Jan 18:392-400.
- Dmytriiev D, Dmytriiev K, Stoliarchuk O, Semenenko Multiple organ dysfunction syndrome: what do we know about pain management? A narrative review. Anaesthesia, Pain & Intensive Care. 2019 Jul 3;23(1).






