Корекція дефіциту заліза у пацієнтів з ХСН: оновлення практичних рекомендацій
Резюме. Європейське товариство кардіологів розглядає дефіцит заліза як поширений коморбідний стан при хронічній серцевій недостатності (ХСН) і надає рекомендації щодо його діагностики та лікування. Незважаючи на це, в клінічній практиці навіть у розвинених країнах дефіцит заліза лишається поза увагою клініцистів, і багато пацієнтів з ХСН не отримують замісної терапії, яка може позитивно впливати на функціонування серцево-судинної системи та самопочуття. Тому 2018 року міжнародна робоча група розробила спеціальні рекомендації зі скринінгу та корекції залізодефіцитного стану в цієї категорії хворих.
Ключові слова: залізодефіцит, хронічна серцева недостатність, Суфер.
Клінічне значення
За різними оцінками, дефіцит заліза мають від 40 до 70% пацієнтів з ХСН [3, 4]. Він може бути зумовлений як виснаженням запасів заліза в організмі через мальабсорбцію, мальнутрицію, приховані крововтрати, так і порушенням мобілізації мікроелемента з місць депонування під впливом прозапальних цитокінів, підвищений рівень яких є типовим для хронічного захворювання.
Дефіцит заліза часто, хоча й не завжди, супроводжується анемією. Наслідки залізодефіциту виходять далеко за межі порушення кровотворення.Скелетні м’язи та міокард залежні від заліза як ключового складника білків, що забезпечують перенос кисню та реакції енергетичного обміну в дихальному ланцюзі мітохондрій. Гіпоксія тканин викликає компенсаторну периферичну вазодилатацію, що веде до підвищення симпатичної активності та зниження ниркового кровотоку.
Для пацієнта з ХСН це означає замикання хибного кола активації ренін-ангіотензинової системи, поглиблення застійних явищ, подальше погіршення відповіді на препарати базисної терапії та діуретики. Зрештою, дефіцит заліза, незалежно від анемії, асоціюється зі зменшеною здатністю до фізичних навантажень, зниженою якістю життя та підвищеним ризиком смерті [2].
Скринінг і діагностичні критерії
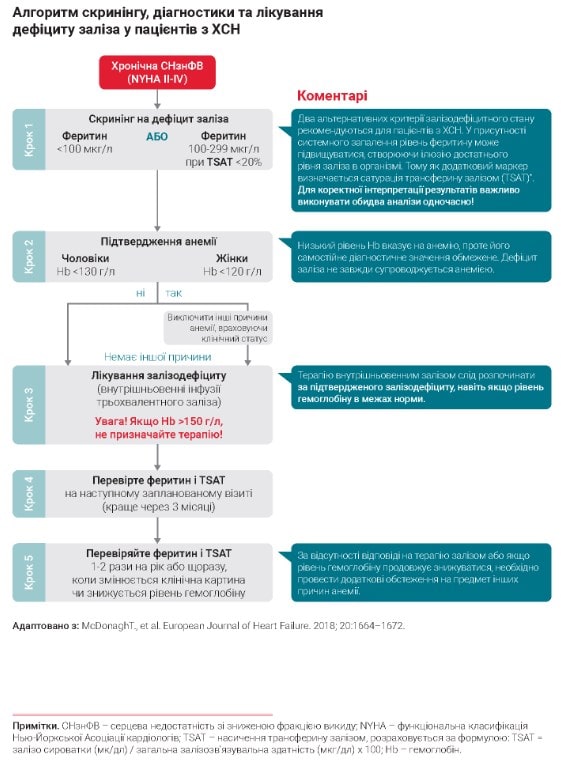
Визначення статусу обміну заліза рекомендовано як частина рутинного обстеження всім пацієнтам – як з уперше діагностованою СН, так і хворим з анамнезом ХСН, під час кожної госпіталізації, а також 1-2 рази на рік в амбулаторних умовах [2]. На рисунку представлено рекомендований алгоритм дій лікаря. На перше місце поставлені два індикатори статусу обміну заліза – феритин сироватки як показник запасів заліза та сатурація трансферина залізом (TSAT), що відображає доступність циркуляційного заліза для забезпечення метаболічних потреб тканин.
Лише ці лабораторні маркери підтверджують дефіцит заліза в організмі та дають підставу призначати замісну терапію. Визначення рівня гемоглобіну є стандартним компонентом загального аналізу крові, який обов’язково призначають сімейні лікарі та кардіологи. Низький рівень гемоглобіну (Hb) є основним маркером анемії, проте його самостійне діагностичне значення обмежене. З одного боку, в пацієнтів з ХСН найчастішою причиною анемії є абсолютний або відносний дефіцит заліза. З іншого боку, дефіцит заліза не обов’язково супроводжується анемією.
Терапію внутрішньовенним залізом рекомендовано розпочинати за підтвердженого залізодефіциту, навіть якщо рівень гемоглобіну в межах норми. Проте рівень гемоглобіну також має важливе практичне значення. Якщо він перевищує 150 г/л, терапія залізом не рекомендується через недостатньо вивчену ефективність. Крім того, за рівнем гемоглобіну розраховується сумарна доза заліза, яку необхідно ввести для корекції дефіциту.
Вибір терапії
У загальній практиці провести корекцію дефіциту заліза можливо двома шляхами – пероральним і внутрішньовенним. Пероральні препарати заліза часто призначаються як терапія першої лінії при лікуванні залізодефіцитної анемії. Проте у пацієнтів з ХСН патофізіологія залізодефіцитного стану має свої особливості, що обмежують ентеральну біодоступність заліза [5]. Через набряк і погіршення мікроциркуляції у ворсинах слизової оболонки кишечника знижується його всмоктувальна здатність.
Крім того, при ХСН під впливом прозапальних цитокінів активується регуляторний білок гепсидин, який знижує абсорбцію заліза в кишечнику та блокує його вихід з місць депонування. Ще одна проблема таблетованого заліза полягає у високій (до 60%) частоті побічних явищ з боку шлунково-кишкового тракту, таких як нудота, здуття, діарея, печія [5]. Обмеження перорального заліза не є суто теоретичним. У клінічному дослідженні IRONOUT-HF пероральний препарат полісахариду заліза не забезпечував необхідної швидкості відновлення запасів цього мікроелемента і не покращував клінічний статус пацієнтів з ХСН порівняно з плацебо [6].
Натомість ефективність внутрішньовенного шляху введення заліза переконливо доведена [2]. З наявних парентеральних препаратів найбільш вивченими з позицій ефективності та безпеки є заліза сахарат і заліза карбоксимальтозат. Експерти робочої групи з корекції дефіциту заліза при ХСН надають перевагу карбоксимальтозату заліза з урахуванням найвищої максимальної дози, яку можна ввести за одну інфузію (1000 мг), що дозволяє швидко відновити запаси мікроелемента в організмі [2].
Проте за доказовою базою ефективності та безпечності заліза гідроксид-сахарозний комплекс не поступається карбоксимальтозату заліза. У рандомізованих дослідженнях схожого дизайну ці препарати забезпечували покращення гематологічних показників (Нb, феритин, TSAT) у пацієнтів з ХСН, що супроводжувалося зростанням фракції викиду (ФВ), покращенням ниркової функції, зменшенням функціонального класу ХСН за NYHA, підвищенням толерантності до навантажень та якості життя пацієнтів при оцінюванні за опитувальниками [7-11].
Порівняльні дослідження різних парентеральних форм заліза не проводилися. Висновки останнього мета-аналізу, що підтвердив клінічну користь лікування дефіциту заліза у пацієнтів з ХСН, ґрунтуються однаковою мірою на результатах досліджень сахарату заліза та карбоксимальтозату заліза [12].
Слід зазначити, що всі докази ефективності терапії залізом стосуються лише пацієнтів з ХСН зі зниженою ФВ. Наразі в дослідженнях FAIR-HFpEF та AFFIRM-AHF вивчаються ефекти терапії при СН зі збереженою ФВ і при гострій СН.
Як проводити замісну терапію
Основний принцип – ввести за курс лікування таку сумарну дозу, яка відповідає загальному дефіциту заліза в організмі. Розрахунок проводиться за формулою Ґанзоні:

Для розрахунку необхідно знати масу тіла пацієнта, його рівень гемоглобіну, а також скористатися даними для підстановки в формулу (див. нижче).
Курс терапії залежить від конкретного препарату, виходячи з максимальної дози для разового введення. Наприклад, призначивши препарат сахарату заліза (Суфер®) чоловіку масою 90 кг з вихідним рівнем гемоглобіну 100 г/л, виконуємо розрахунок:
загальний дефіцит заліза = 90×(150–100) × 0,24+500=1580 мг.
1 мл розчину Суфер® містить 20 мг заліза. Розрахунок загальної кількості препарату:
1580 мг/20мг/мл = 79 мл.
Кумулятивну дозу 79 мл можна розділити на інфузії максимальною разовою дозою 25 мл 1 р/тиж або на ін’єкції по 10 мл 3 р/тиж, або комбінувати обидва способи введення. Гнучкий розподіл дози дозволяє проводити терапію як у стаціонарі, так і на амбулаторних візитах.
Оцінювати ефективність терапії рекомендується через 3 місяці за показниками феритину та ТSAT. За відсутності відповіді на терапію залізом або якщо рівень гемоглобіну продовжує знижуватися необхідно провести додаткові обстеження на предмет інших причин анемії.

За даними інформаційно-аналітичної бази Система дослідження ринку «PharmXplorer», в Україні найбільш використовуваним парентеральним препаратом заліза з 2017 року є Суфер® від компанії «Юрія-Фарм». Компанія «Юрія-Фарм» – лідер у виробництві інфузійних препаратів в Україні, добре відома в більш ніж 40 країнах світу. Зокрема Суфер® експортується в Таджикістан та Узбекістан. Суфер® – це внутрішньовенний сахарозний комплекс тривалентного заліза, що випускається в ампулах по 5 мл (100 мг активної речовини).
Також є форма випуску, де флакон 10 мл (200 мг заліза) комплектується розчинником – 100 мл натрію хлориду, та має зручну систему приготування розчину перед використанням, що особливо важливо в умовах реанімації. Відсутність декстрану в препараті Суфер® забезпечує його високу безпеку щодо розвитку алергічних реакцій і дозволяє широко використовувати для корекції дефіциту заліза у вагітних жінок. Висока популярність препарату Суфер® серед лікарів різних спеціальностей пояснюється тим, що заліза гідроксид-сахарозний комплекс швидко та безпечно корегує дефіцит заліза в організмі та має оптимальне співвідношення якість – ціна.
Автори:
Л.Г. Воронков
Література:
- 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: TheTask Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2016;18:891–975.
- McDonagh T., et al. Screening, diagnosis and treatment of iron deficiency in chronic heart failure: putting the 2016 European Society of Cardiology heart failure guidelines into clinical practice. European Journal of Heart Failure. 2018;20: 1664–1672. doi:10.1002/ejhf.1305.
- Klip I.T., Comin-Colet J., Voors A.A.,et al. Iron deficiency in chronic heart failure: an international pooled analysis. AmHeart J. 2013;165:575–582.e3.
- von Haehling S., Gremmler U., Krumm M., et al. Prevalence and clinical impact of irondeficiency and anaemia among out patients with chronic heart failure: The PrEPRegistry. ClinResCardiol. 2017;106:436–443.
- McDonagh T., Macdougall I.C. Iron therapy for the treatment of irondeficiency in chronic heart failure: intravenousororal? Eur J HeartFail. 2015;17:248–262.
- Lewis G.D., Malhotra R., Hernandez A.F., et al. Effect of oral iron repletion on exercise capacity in patients with heart failure with reduce dejection fraction and iron deficiency: the IRONOUT HF randomized clinical trial. JAMA. 2017;317:1958–1966.
- Anker S.D., Comin Colet J., Filippatos G., Willenheimer R., Dickstein K., Drexler H., Luscher T.F., Bart B., Banasiak W., Niegowska J., Kirwan B.A., Mori C., von EisenhartRothe B., Pocock S.J., Poole-Wilson P.A., Ponikowski P.; FAIR-HF Trial Investigators. Ferric carboxymaltose in patients with heart failure and iron defciency. N Engl J Med. 2009;361:2436–2448.
- Okonko D.O., Grzeslo A., Witkowski T., et al. Effect of intravenous iron sucrose on exercise tolerance in anemic and nonanemic patients with symptomatic chronic heart failure and iron deficiency. FERRIC-HF: a randomized, controlled, observer-blinded trial. J Am CollCardiol. 2008;51:103–112.
- Ponikowski P., van Veldhuisen D.J., Comin-Colet J., Ertl G., Komajda M., Mareev V., McDonagh T., Parkhomenko A., Tavazzi L., Levesque V., Mori C., Roubert B., Filippatos G., Ruschitzka F., Anker S.D.; CONFIRM-HF Investigators. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J. 2015;36:657–668.
- Toblli J.E., Lombrana A., Duarte P., Di Gennaro F. Intravenous iron reduces NT-pro-brain natriuretic peptide in anemic patients with chronic heart failure and renal insuffciency. J Am CollCardiol. 2007;50:1657–1665.
- Beck-da-Silva L., Piardi D., Soder S., et al. IRON-HF study: a randomized trial to assess the effects of iron in heart failure patients with anemia. Int J Cardiol. 2013;168:3439–3442.
- Jankowska E.A., Tkaczyszyn M., Suchocki T., et al. Effects of intravenous iron therapy in iron-defcient patients with systolic heart failure: a meta-analysis of randomized controlled trials. Eur J Heart Fail. 2016;18:786–795.






