Перші результати міжнародного багатоцентрового клінічного дослідження RheoSTAT-CP0620 щодо ефективності та безпеки інфузійного розчину Реосорбілакт® у комплексній терапії сепсису

Резюме: Сепсис залишається поширеним і життєзагрозливим патологічним станом, госпітальна смертність за экого перевищує 30 %. Важливою складовою лікування сепсису є інфузійна терапія. Метою цього дослідження було оцінити ефективність і безпеку багатокомпонентного інфузійного розчину Реосорбілакт у терапії пацієнтів із сепсисом.
У міжнародному багатоцентровому рандомізованому дослідженні RheoSTAT-CP0620 узяли участь 180 пацієнтів віком від 18 до 60 років із діагнозом сепсису. Пацієнти отримували терапію препаратом Реосорбілакт у дозуванні відповідно до інструкції для медичного застосування. Первинним показником ефективності терапії вважалася зміна оцінки за шкалою SOFA на 3-й день терапії. Як вторинні показники розглядалися зміни оцінки за шкалами APACHE II, SAPS II та MODS, а також зміна маркерів ендогенної інтоксикації на 3-й день терапії.
Безпека препарату оцінювалася за допомогою аналізу небажаних явищ і життєво важливих показників через 3 дні терапії. На 3-й день лікування препаратом Реосорбілакт було зафіксовано статистично значущі зміни оцінки за шкалами SOFA (на 2,01±1,37 бала), APACHE II (на 4,24±3,76 бала), SAPS II (на 3,40±5,30 бала) та MODS (на 1,37±1,37 бала). Крім того, було виявлено статистично значуще покращення маркерів ендогенної інтоксикації (концентрації сечовини, креатиніну та загального білірубіну, кількості лейкоцитів і розрахункових індексів інтоксикації) на 3-й день лікування.
Більшість небажаних явищ (71,74 %) були легкими. Жодне з небажаних явищ не було пов’язане з досліджуваним препаратом і не призвело до вибування пацієнта з дослідження. Згідно з отриманими результатами, Реосорбілакт є ефективним і безпечним препаратом для лікування пацієнтів із сепсисом. Дослідження RheoSTAT-CP0620 обґрунтовує доцільність включення препарату Реосорбілакт у рутинні алгоритми лікування пацієнтів із сепсисом.
Ключові слова: сепсис, інфузійна терапія, Реосорбілакт, інтоксикація, поліорганна недостатність.
Вступ
Сепсис залишається поширеним і життєзагрозливим патологічним станом. Щороку сепсис діагностується приблизно в 19 млн осіб [5, 6]. Значну розповсюдженість сепсису в наш час, імовірно, можна пояснити зростанням поширеності хронічних хвороб у популяції, що старіє, збільшенням антибіотикорезистентності, а також підвищенням частоти проведення інвазивних процедур, застосування імуносупресивних ліків і хіміотерапії [18]. Незважаючи на значне вдосконалення медичної допомоги хворим у критичному стані, госпітальна смертність у разі сепсису перевищує 30 % [2-4].
Відповідно до третього міжнародного консенсусу щодо визначень сепсису та септичного шоку (2016), сепсис – це життєзагрозлива дисфункція органів, спричинена дисрегульованою відповіддю організму-господаря на інфекцію. Дисфункцію органів вважають такою, що загрожує життю, на основі підвищення оцінки за шкалою SOFA (Sequential [Sepsis-related] Organ Failure Assessment) на ≥2 бали [3]. Раннє розпізнання та швидке надання медичної допомоги при сепсисі зменшує захворюваність і смертність.
Сучасна концепція лікування сепсису передбачає виконання певних процедур у визначений час. Зокрема, після перевірки стану дихальних шляхів і стабілізації дихання пацієнтам проводяться інфузійна терапія (ІТ), антибіотикотерапія, визначення лактату та посів культур бактерій [10-13].
Від часу винаходу інфузійних розчинів тривають дискусії щодо того, який саме розчин є оптимальним для пацієнтів з інфекційними процесами, котрі перебувають у тяжкому стані [36]. Ідеальний для застосування при сепсисі інфузійний препарат має збільшувати внутрішньосудинний об’єм без накопичення в тканинах, мати подібний до плазми хімічний склад, покращувати наслідки лікування та бути економічно доцільним. Не кожному розчину для інфузій притаманні всі перелічені властивості, тому питання оптимальної ІТ при сепсисі досі гостро стоїть перед лікарями-клініцистами.
Монокомпонентні розчини не дають можливості реалізувати всі завдання ІТ при сепсисі, тому основою сучасної ІТ виступають багатокомпонентні інфузійні препарати. У зв’язку з актуальністю цього питання та відсутністю однозначно визнаного оптимального інфузійного розчину метою цієї роботи стало вивчення ІТ при сепсисі на основі даних літератури й аналізу результатів рандомізованого контрольованого дослідження (РКД) IV фази RheoSTAT-CP0620.
Це багатоцентрове РКД було проведено з метою оцінки ефективності та безпеки препарату поліфункціональної дії Реосорбілакт, до складу якого входять сорбітол (60 г), натрію лактат (19 г), натрію хлорид (6 г), кальцію хлорид (0,1 г), калію хлорид (0,3 г), магнію хлорид (0,2 г) та вода для ін’єкцій (до 1 л). Осмолярність препарату становить 891 мОсм/л, рН – 6,0-7,6.
У ході дослідження в пацієнтів із сепсисом, які отримували терапію препаратом Реосорбілакт, оцінювали динаміку балів за інтегральними шкалами SOFA, MODS (Multiple Organ Dysfunction), APACHE II (Acute Physiology And Chronic Health Evaluation II), SAPS II (Simplified Acute Physiology Score ІІ) шляхом порівняння вихідного показника та показника на 3-й день лікування; життєво важливі показники (температура тіла, частота серцевих скорочень – ЧСС, систолічний і діастолічний артеріальний тиск – АТ, частота дихання); динаміку змін показників клінічного та біохімічного аналізу крові, а також газового складу крові.
Матеріали та методи
Було проведено електронний пошук у англомовних джерелах бази даних PubMed за останні 20 років за ключовими словами “sepsis”, “septic shock”, “fluid resuscitation”, “sepsis resuscitation”, “infusion”. Також було проаналізовано огляд результатів міжнародного багатоцентрового відкритого РКД IV фази із засліпленою оцінкою кінцевих точок ефективності RheoSTAT-CP0620 на підставі звіту, наданого компанією «Юрія-Фарм». Це дослідження, що тривало з 07.10.2017 по 11.12.2019, здійснювалося контрактною дослідною організацією відповідно до принципів Належної клінічної практики (ICH GCP), етичних норм Гельсінкської декларації Всесвітньої медичної асоціації та національних стандартів.
РКД RheoSTAT включало 629 пацієнтів із сепсисом, перитонітом, опіковою хворобою та пневмонією, котрі лікувалися в 37 клінічних центрах 6 країн. У субдослідженні RheoSTAT-CP0620 sepsis брали участь 180 пацієнтів із 12 клінічних центрів 5 країн – України, Молдови, Грузії, Узбекистану та Казахстану. У це субдослідження включали госпіталізованих дорослих пацієнтів обох статей із верифікованим діагнозом сепсису, встановленим не більш ніж за 24 години до скринінгу, що відповідали критеріям включення.
Останніми виступали вік 18-60 років; встановлений за критеріями ACCP/SCCM діагноз «сепсис»; час від моменту встановлення діагнозу «сепсис» до візиту скринінгу – не більш ніж 24 години; підписана інформована згода на участь у дослідженні; вихідна оцінка за шкалою SOFA ≥2 бали.
У дослідження було включено 180 пацієнтів, 89 з яких було рандомізовано до групи препарату Реосорбілакт. Аналіз даних виконувався в кількох популяціях: 1) популяція всіх включених у дослідження пацієнтів (intent-to-treat, ITT), що включала всіх рандомізованих пацієнтів, яким була призначена та введена хоча б одна інфузія та в яких наявні дані щодо бала SOFA як до, так і після проведення цієї інфузії (79/89 осіб, 88,76 %); 2) популяція за протоколом (per protocol, PP), що включала всіх рандомізованих пацієнтів, які завершили участь у дослідженні відповідно до протоколу (закінчили призначений період лікування та спостереження без істотних відхилень від протоколу дослідження) (74/89 осіб, 83,15 %); 3) популяція безпеки (safety), що включала всіх рандомізованих пацієнтів, яким була проведена хоча б одна інфузія та хоча б один візит оцінки параметрів безпеки (89 осіб, 100 %). Основною популяцією для оцінки первинного параметру ефективності виступала популяція ITT.
Учасники основної групи (n=89) впродовж 3 днів отримували інфузійний розчин Реосорбілакт шляхом внутрішньовенної інфузії в дозі 200-400 мл/добу відповідно до інструкції для медичного застосування препарату. На 3-й день у них оцінювали критерії ефективності, а через 14±2 дні контролювали безпеку та наслідки хвороби (рис. 1).
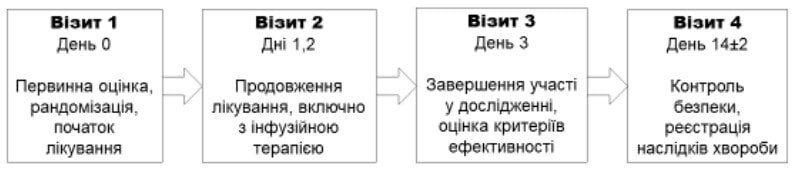 Рис. 1. Дизайн дослідження RheoSTAT-CP0620
Рис. 1. Дизайн дослідження RheoSTAT-CP0620
Візит 1 День 0
Первинна оцінка, рандомізація, початок лікування
Візит 2 Дні 1, 2
Продовження лікування, включно з інфузійною терапією
Візит 3 День 3
Завершення участі в дослідженні, оцінка критеріїв ефективності
Візит 4 День 14±2
Контроль безпеки, реєстрація наслідків хвороби
Варто відзначити ретельну й об’єктивну оцінку ефективності та безпеки досліджуваного препарату, яка здійснювалася на підставі численних оцінювальних шкал і клініко-лабораторних показників, представлених у таблиці 1.
Табл. 1. Критерії оцінки ефективності та безпеки в дослідженні RheoSTAT-CP0620
|
Оцінка ефективності проводилася шляхом порівняння початкових показників під час госпіталізації та показників на 3-й день терапії |
|
Основний параметр: зміна загального бала за шкалою SOFA Вторинні параметри: • Зміна загального бала за шкалами APACHE II, SAPS II та MODS • Оцінка ендогенної інтоксикації на підставі 1) біохімічних маркерів: концентрації в сироватці крові глюкози, лактату, пірувату, сечовини, креатиніну, аланінамінотрансферази (АлАТ), аспартатамінотрансферази (АсАТ), лактатдегідрогенази, лужної фосфатази, креатинфосфокінази, гаммаглутамілтранспептидази, речовин середньої та низької молекулярної маси та середньомолекулярних олігопептидів, альбумінової фракції, загальної й ефективної концентрації альбуміну, індексу токсичності та зв’язувальної здатності альбуміну, рівня прокальцитоніну; 2) імунологічних критеріїв: кількісний вміст лейкоцитів, лімфоцитів, тромбоцитів із розрахунком лейкоцитарного, ядерного та гематологічного індексів інтоксикації (ІІ), відношення нейтрофілів і лімфоцитів, концентрація С-реактивного білка, імуноглобулінів, інтерлейкінів 1 і 2, компонентів комплементу 3 та 4; 3) клінічних ознак (адинамія, апатія, слабкість, порушення пам’яті та сну, дратівливість, анорексія), параметрів електрокардіограми, показників центральної гемодинаміки й оцінки свідомості за шкалою Глазго |
|
Оцінка безпеки |
|
• Загальна частота небажаних явищ (НЯ) • Частота серйозних НЯ • Частота НЯ, пов’язаних із застосуванням досліджуваного препарату • Частота НЯ, що призвели до вибування пацієнта з дослідження • Частота НЯ, раніше не описаних в інструкції з використання досліджуваного препарату • Частота виникнення поліорганної недостатності • Загальне виживання пацієнтів (%) під час подальшого спостереження (день 14±2) |
Результати та їх обговорення
Протягом тривалого часу наріжним каменем лікування сепсису вважалася агресивна великооб’ємна ІТ [11]. Цей підхід ґрунтувався на теорії, що септичний шок являє собою форму гіповолемічного шоку, а отже, характеризується гіпоперфузією тканин [14]. Проте з’ясувалося, що агресивна великооб’ємна ІТ неминуче призводить до масивного перевантаження рідиною. Небезпеки цього підходу були чітко продемонстровані в трьох великих багатоцентрових РКД – ProCESS, ARISE та ProMISe [26, 27], однак, на жаль, така тактика й далі використовується в медичних закладах. Сучасні експериментальні, обсерваційні та рандомізовані клінічні дослідження свідчать, що малооб’ємна ІТ забезпечує кращі клінічні результати [14-17].
Рекомендації Surviving Sepsis Campaign (кампанія «Виживання при сепсисі») передбачають швидке введення щонайменше 30 мл/кг кристалоїдного розчину при гіпотензії чи вмісті лактату ≥4 ммоль/л, але, хоча рекомендація має статус сильної, якість її доказової бази низька, тобто ця вказівка ґрунтується переважно на експертній думці [11].
Тактика призначення 30 мл інфузійного розчину на кг маси тіла має кілька вагомих недоліків. Передусім у рекомендаціях не вказано, який показник маси тіла слід використовувати для розрахунків: реальний, розрахований чи ідеальний для конкретного зросту. Наприклад, якщо використовувати показник реальної ваги, то пацієнту вагою 150 кг потрібно ввести рідинний болюс об’ємом 4500 мл, що супроводжується високим ризиком асоційованих із гіперволемією ускладнень і смертності, особливо за наявності серцевої чи ниркової недостатності [20].
Крім того, в умовах лікування септичного шоку рідко є можливість абсолютно точно визначити зріст і вагу пацієнта [28-30]. Слід зауважити, що стандартний підхід уведення 30 мл рідини на кг маси тіла суперечить сучасній парадигмі максимальної індивідуалізації будь-якого лікування, в тому числі ІТ [27, 31].
Отже, ідея великооб’ємної ІТ ґрунтується на неправильному розумінні патофізіології сепсису. У цій концепції центральною ланкою патогенезу хвороби вважається гіпоперфузія. Типові ознаки септичного шоку (підвищення концентрації лактату в крові, олігурія, печінкова дисфункція та розлади свідомості) трактувались як наслідки гіпоперфузії відповідних органів, а агресивна ІТ була покликана різко підвищити серцевий викид, усунувши цю гіпоперфузію. Нині відомо, що така концепція є надмірно спрощеною й неточною.
З’являється дедалі більше доказів того, що мозкова, серцева, ниркова та печінкова дисфункція при сепсисі переважно спричиняються біоенергетичною недостатністю, а не мікроциркуляторною дисфункцією та порушеною перфузією. Це підтверджується тим, що в пацієнтів із сепсисом крива Франка – Старлінга зміщується вниз і праворуч, тобто в умовах сепсису серце слабко реагує на рідинне навантаження [20]. У пацієнтів із септичним шоком агресивна ІТ спричиняє мінімальне підвищення кінцево-діастолічного й ударного об’єму, натомість різко підвищуючи тиск у лівому передсерді з подальшим розвитком набряку легень і в правому передсерді з подальшим зростанням тиску у венах печінки та нирок, а отже, розвитком недостатності цих органів [32].
Унаслідок зростання гідростатичного тиску в легеневих судинах і венах печінки та нирок посилюється вивільнення натрійуретичних пептидів, а рідина переміщується в інтерстиційний простір, провокуючи набряк тканин. Останній, своєю чергою, спричиняє порушення мікроархітектури тканин, перешкоджає капілярному кровотоку й лімфовідтоку, порушує міжклітинну взаємодію та сповільнює дифузію кисню й метаболітів [33, 34].
Спектр ускладнень великооб’ємної ІТ включає порушення свідомості, набряк мозку та легень, плевральний випіт, порушення скоротливості міокарда, зменшення швидкості клубочкової фільтрації, уремію, погіршення моторної функції кишківника, асцит, погіршення функції печінки [20]. Малооб’ємна ІТ дає можливість уникнути перелічених ускладнень і покращити наслідки для пацієнта [35].
Протягом останніх десятиліть основою ІТ є застосування багатокомпонентних інфузійних препаратів. Серед сорбітоловмісних засобів варто відзначити комплексний інфузійний препарат поліфункціональної дії Реосорбілакт («Юрія-Фарм», Україна). Крім сорбітолу, він містить інші важливі електроліти, а саме калій, кальцій і магній.
Вміст хлоридів у Реосорбілакті становить лише 112,7 ммоль/л, що зменшує ризик гіперхлоремічного ацидозу. Важливим складником цього інфузійного розчину є натрію лактат, який забезпечує олужнювальний вплив, корегуючи метаболічний ацидоз, що часто ускладнює тяжкі інфекції, сепсис, перитоніт, кишкову непрохідність, ниркову недостатність, опіки, шок, хронічну гіпоксію тощо.
Реосорбілакт сприятливо впливає на роботу серця, регенерацію тканин і дихальну функцію крові, стимулює функції системи мононуклеарних фагоцитів, має дезінтоксикаційну дію, посилює діурез, покращує функціонування нирок і печінки. Успішний досвід застосування Реосорбілакту для дезінтоксикації та нормалізації реологічних властивостей крові в пацієнтів із тяжкими гнійно-запальними хворобами, як-от перитоніт [33], деструктивний панкреатит [34], синдром діабетичної стопи [35], дає змогу припускати покращення клінічних наслідків у разі сепсису.
Загалом наявність у складі Реосорбілакту сорбітолу та натрію лактату, які здатні потенціювати дезінтоксикаційні властивості один одного, а також корегувати кислотно-лужний стан і водно-електролітний баланс, ставить цей препарат в один ряд із потужними дезінтоксикаційними засобами [37].
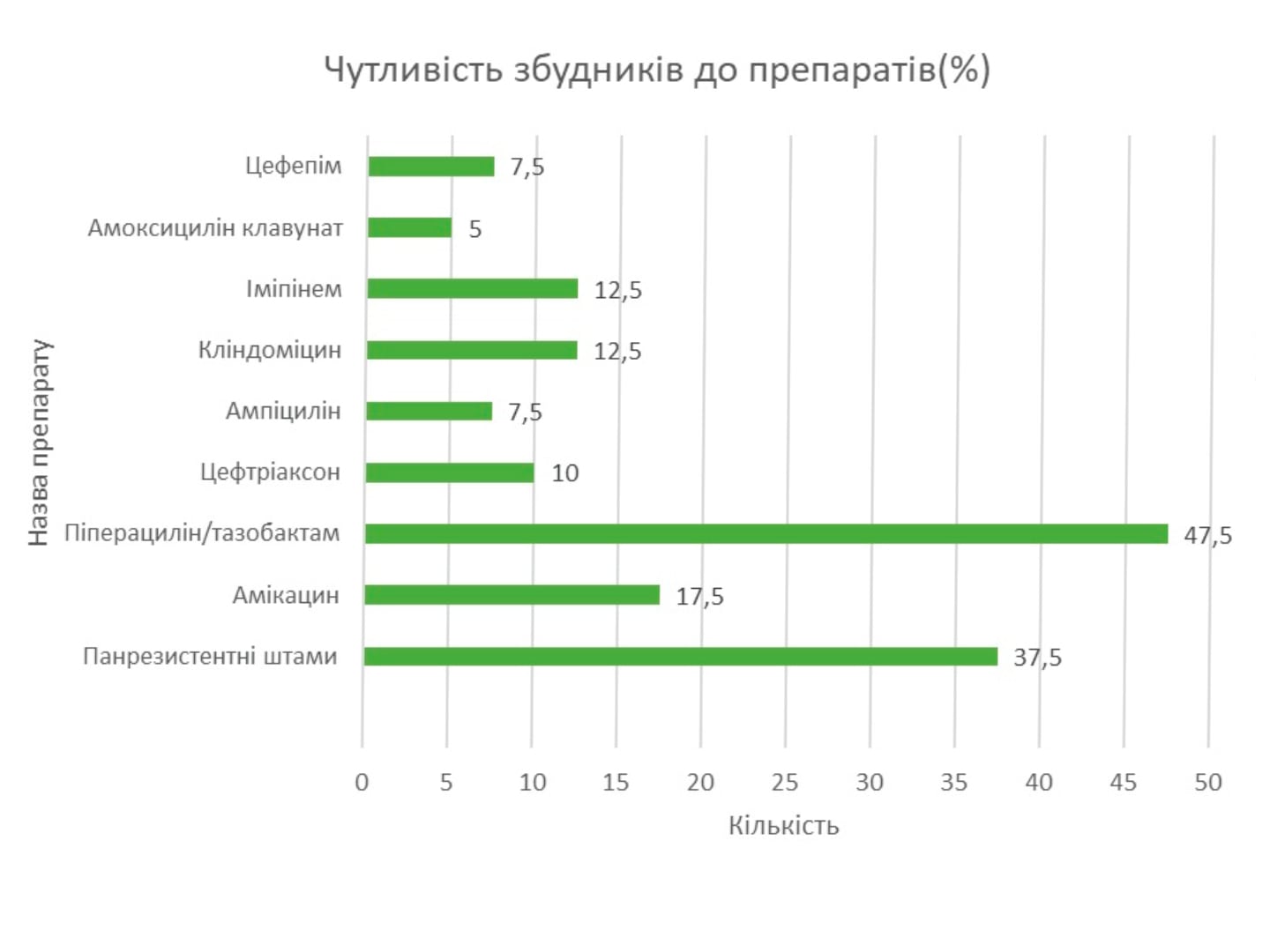
За клінічною характеристикою популяції дослідження, середній вік пацієнтів субдослідження RheoSTAT-CP0620 sepsis дорівнював 40,42±13,28 року. Чоловіки становили 69,66 % групи. Більшість учасників не курили (69,66 %) та не вживали алкоголь (74,16 %). Супутні захворювання були зареєстровані у 27/89 (30,3 %) пацієнтів групи Реосорбілакту. Найбільша кількість випадків належала до класів «Інфекції та інвазії» (7,9 %), «Розлади з боку серця» (6,7 %), «Розлади з боку судин» (5,6 %).
Аналіз динаміки бальної оцінки за проаналізованими шкалами виявив сприятливі зміни на тлі застосування Реосорбілакту (рис. 2, 3; табл. 2).
Зміна загального бала за шкалою SOFA на 3-й день порівняно з вихідним значенням
Популяція ITT
При надходженні середнє значення (± стандартне відхилення) за шкалою SOFA становило 3,08±1,10 бала, а на 3-й день – 1,08±1,16 бала (рис. 2). Отже, середня зміна оцінки за шкалою SOFA на 3-й день лікування порівняно з вихідним рівнем дорівнювала 2,01±1,37 бала (табл. 2).
При проведенні додаткового аналізу було виявлено, що зміни середнього значення за шкалою SOFA на 3-й день у пацієнтів, які отримували Реосорбілакт, були статистично значущими порівняно зі значеннями при надходженні (р<0,001).
Популяція PP
При надходженні середнє значення (± стандартне відхилення) за шкалою SOFA становило 3,04±1,07 бала, а на 3-й день – 1,03±1,11 бала (рис. 3). Отже, середня зміна оцінки за шкалою SOFA на 3-й день лікування порівняно з вихідним рівнем дорівнювала 2,03±1,36 бала (табл. 2).
Зміна загального бала за шкалою APACHE II на 3-й день порівняно з вихідним значенням
Популяція ITT
При надходженні середнє значення (± стандартне відхилення) за шкалою APACHE II становило 7,57±3,72 бала, а на 3-й день – 3,36±2,79 бала (рис. 2). Середня зміна оцінки за шкалою APACHE II через 3 дні лікування дорівнювала 4,24±3,76 бала (табл. 2).
При проведенні додаткового аналізу було виявлено, що зміни середнього значення за шкалою APACHE II на 3-й день у пацієнтів, які отримували Реосорбілакт, були статистично значущими порівняно зі значеннями при надходженні (р<0,001).
Популяція РР
При надходженні середнє значення (± стандартне відхилення) за шкалою APACHE II становило 7,30±3,66 бала, а на 3-й день лікування – 3,36±2,79 бала (рис. 3). Середня зміна оцінки дорівнювала 4,26±3,66 бала.
Зміна загального бала за шкалою SAPS II на 3-й день порівняно з вихідним значенням
Популяція ITT
При надходженні середнє значення (± стандартне відхилення) за шкалою SAPS II становило 15,62±7,20 бала, а на 3-й день лікування – 12,42±5,16 бала (рис. 2). Середня зміна оцінки за шкалою SAPS II на 3-й день порівняно з вихідним показником дорівнювала 3,40±5,30 бала (табл. 2).
При проведенні додаткового аналізу було виявлено, що зміни середнього значення за шкалою SAPS II на 3-й день у пацієнтів, які отримували Реосорбілакт, були статистично значущими порівняно зі значеннями при надходженні (р<0,001).
Популяція РР
При надходженні середнє значення (± стандартне відхилення) за шкалою SAPS II становило 15,20±7,10 бала, а на 3-й день лікування – 12,26±5,16 бала (рис. 3). Отже, середня зміна оцінки за шкалою SAPS II дорівнювала 3,15±5,16 бала.
Зміна загального бала за шкалою MODS на 3-й день порівняно з вихідним значенням
Популяція ITT
При надходженні середнє значення (± стандартне відхилення) за шкалою MODS становило 2,08±1,20 бала, а на 3-й день лікування – 0,73±1,19 бала (рис. 2). Середня зміна оцінки за шкалою MODS на 3-й день порівняно з вихідним рівнем дорівнювала 1,37±1,37 бала (табл. 2).
При проведенні додаткового аналізу було виявлено, що зміни середнього значення за шкалою MODS на 3-й день у пацієнтів, які отримували Реосорбілакт, були статистично значущими порівняно зі значеннями при надходженні (р<0,001).
Популяція РР
При надходженні середнє значення (± стандартне відхилення) за шкалою MODS становило 2,05±1,20 бала. На 3-й день лікування цей показник становив 0,73±1,19 бала (рис. 3). Отже, середня зміна оцінки за шкалою MODS дорівнювала 1,36±1,41 бала.
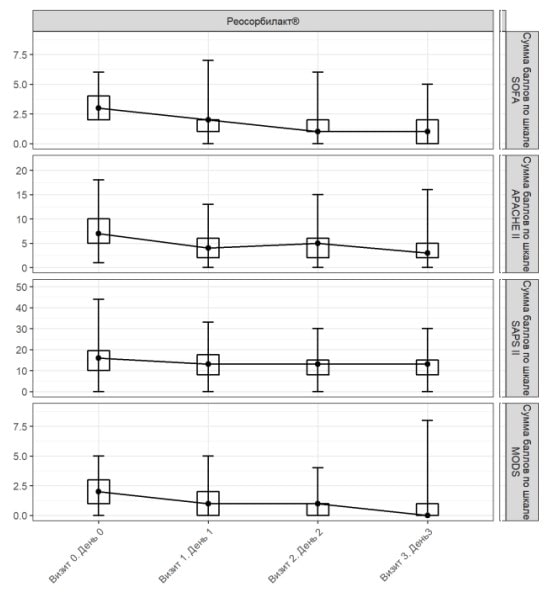 Рис. 2. Динаміка оцінки за шкалами SOFA, APACHE II, SAPS II та MODS у популяції ITT
Рис. 2. Динаміка оцінки за шкалами SOFA, APACHE II, SAPS II та MODS у популяції ITT
Реосорбілакт
Сума балів за шкалою SOFA Сума балів за шкалою APACHE II
Сума балів за шкалою SAPS II Сума балів за шкалою MODS
Візит 0. День 0 Візит 1. День 1
Візит 2. День 2 Візит 3. День 3
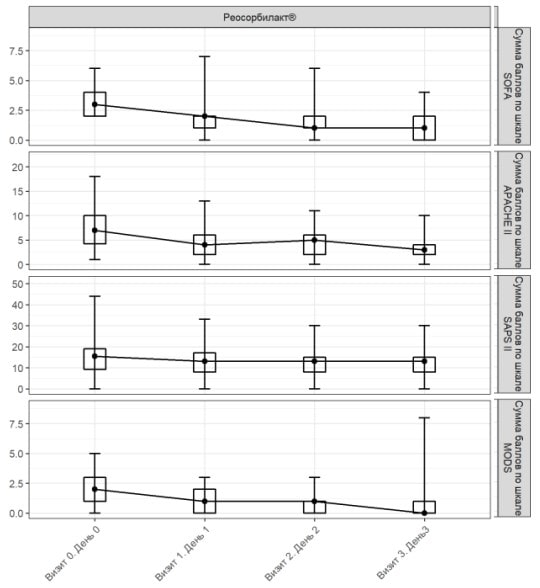 Рис. 3. Динаміка оцінки за шкалами SOFA, APACHE II, SAPS II та MODS у популяції PP
Рис. 3. Динаміка оцінки за шкалами SOFA, APACHE II, SAPS II та MODS у популяції PP
Реосорбілакт
Сума балів за шкалою SOFA Сума балів за шкалою APACHE II
Сума балів за шкалою SAPS II Сума балів за шкалою MODS
Візит 0. День 0 Візит 1. День 1
Візит 2. День 2 Візит 3. День 3
Табл. 2. Зміна бальної оцінки за всіма застосованими шкалами
|
Показник |
Вихідний рівень |
Рівень на 3-й день лікування |
Середня зміна |
р |
|
Оцінка за шкалою SOFA |
3,08±1,10 |
1,08±1,16 |
2,01±1,37 |
<0,001 |
|
Оцінка за шкалою APACHE II |
7,57±3,72 |
3,36±2,79 |
4,24±3,76 |
<0,001 |
|
Оцінка за шкалою SAPS II |
15,62±7,20 |
12,42±5,16 |
3,40±5,30 |
<0,001 |
|
Оцінка за шкалою MODS |
2,08±1,20 |
0,73±1,19 |
1,37±1,37 |
<0,001 |
Додатковий аналіз змін вивчених параметрів на 3-й день лікування порівняно з вихідним рівнем виявив, що на тлі використання Реосорбілакту спостерігалося не лише статистично достовірне зниження вираженості поліорганної недостатності та тяжкості стану за всіма застосованими шкалами (SOFA, APACHE II, SAPS II, MODS II), а й зниження вираженості ендогенної інтоксикації відповідно до вивчених біохімічних та імунологічних показників, а також покращення клінічних параметрів (зниження середньої температури тіла та ЧСС, підвищення показників систолічного та діастолічного АТ, зменшення частоти дихання) (табл. 3).
Табл. 3. Параметри оцінки ефективності Реосорбілакту до та після проведеної терапії
|
Показники, одиниці |
Початкові |
На 3-й день |
р |
||||
|
n |
Ме |
МКД |
n |
Ме |
МКД |
||
|
Сума балів за шкалою |
|||||||
|
SOFA |
79 |
2 |
2-4 |
78 |
1 |
0-2 |
<0,001 |
|
APACHE II |
79 |
7 |
5-10 |
78 |
3 |
2-5 |
<0,001 |
|
SAPS II |
79 |
16 |
10-19,5 |
78 |
13 |
8-15 |
<0,001 |
|
MODS |
79 |
2 |
1-3 |
78 |
0 |
0-1 |
<0,001 |
|
Температура тіла, °С |
79 |
38,2 |
37,0-38,7 |
78 |
36,8 |
36,7-37,3 |
<0,001 |
|
ЧСС, уд./хв |
79 |
96 |
82-106 |
78 |
80 |
74,25-88 |
<0,001 |
|
Систолічний АТ, мм рт. ст. |
79 |
120 |
110-130 |
78 |
120 |
115-130 |
<0,001 |
|
Діастолічний АТ, мм рт. ст. |
79 |
70 |
60-80 |
78 |
80 |
70-80 |
<0,001 |
|
Частота дихання за 1 хв |
79 |
20 |
18-22 |
78 |
18 |
16-20 |
<0,001 |
|
Сечовина, ммоль/л |
79 |
5,24 |
3,85-7,75 |
78 |
4,5 |
3,70-6,20 |
0,029 |
|
Креатинін, мкмоль/л |
79 |
90 |
69,67-112,50 |
78 |
76,28 |
60,00-94,28 |
<0,001 |
|
Загальний білірубін, мкмоль/л |
79 |
13,8 |
10,01-28,40 |
78 |
10,4 |
8,10-13,70 |
<0,001 |
|
АлАТ, МО/л |
79 |
25,0 |
12,25-38,85 |
78 |
24,5 |
9,48-36,60 |
0,194 |
|
АсАТ, МО/л |
79 |
26,5 |
13,10-48,62 |
78 |
29,0 |
12,32-36,98 |
0,363 |
|
Альбумінова фракція, % |
14 |
52,65 |
42,00-57,98 |
14 |
54,65 |
49,10-57,65 |
0,327 |
|
C-реактивний протеїн, мг/л |
73 |
32,7 |
17,50-176,00 |
71 |
24,0 |
9,65-96,00 |
<0,001 |
|
Лактатдегідрогеназа, Од/л |
74 |
301,5 |
197,25-406,25 |
70 |
235,75 |
180,50-312,50 |
>0,05 |
|
Тромбоцити, ×109/л |
79 |
225 |
188,75-292,00 |
76 |
242,5 |
199,50-292,50 |
0,255 |
|
Лейкоцити, ×109/л |
79 |
14,5 |
11,00-17,10 |
77 |
8,8 |
7,09-10,80 |
<0,001 |
|
Ядерний ІІ |
47 |
0,19 |
0,10-0,42 |
46 |
0,09 |
0,04-0,15 |
<0,001 |
|
Лейкоцитарний ІІ |
40 |
5,12 |
3,53-9,35 |
44 |
2,35 |
1,33-4,22 |
<0,001 |
|
Гематологічний ІІ |
40 |
5,29 |
3,55-7,23 |
44 |
4,0 |
2,54-5,25 |
0,002 |
|
Індекс нейтрофіли/лімфоцити |
48 |
7,28 |
4,88-11,00 |
46 |
5,33 |
3,37-8,45 |
0,014 |
|
Надлишок основ, ммоль/л |
67 |
-0,50 |
-3,75-2,10 |
66 |
1,20 |
-0,75-2,58 |
<0,001 |
|
Стандартний бікарбонат, ммоль/л |
63 |
23,8 |
20,75-25,30 |
62 |
24,3 |
23,25-26,35 |
0,013 |
Примітки: * дані зі звіту про результати РКД RheoSTAT-CP0620, наданого компанією «Юрія-Фарм»; n – кількість спостережень; Ме [МКД] – медіана [міжквартильний діапазон].
Слід зауважити, що вже на 3-й день терапії Реосорбілактом було виявлено зменшення частоти відхилень лабораторних показників функції елімінаційних органів, рівнів глюкози й електролітів крові, в тому числі клінічно значущих (рис. 4). Зокрема, спостерігалося зменшення концентрації глюкози (з 6,70 (5,60-8,45) до 5,50 (4,80-6,20) ммоль/л), лактату (з 1,65 (1,00-1,91) до 1,55 (1,20-1,83) ммоль/л), сечовини (з 5,24 (3,85-7,75) до 4,50 (3,70-6,20) ммоль/л; р<0,001), креатиніну (з 90,00 (69,67-112,50) до 76,28 (60,00-94,28) ммоль/л; р<0,001), загального білірубіну (з 13,80 (10,01-28,40) до 10,40 (8,10-13,70) мкмоль/л; р<0,001). Концентрація АсАТ та АлАТ достовірно не змінилася.
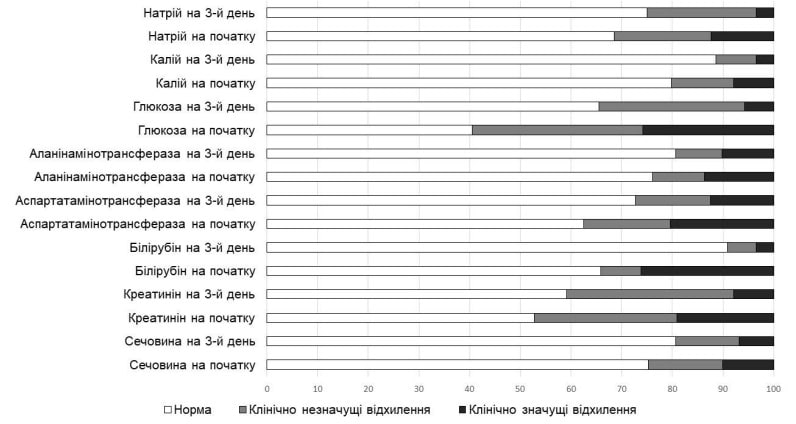
Рис. 4. Відсоток відхилень показників функції елімінаційних органів, глюкози й електролітів крові до та після 3-денного курсу лікування Реосорбілактом
Норма Клінічно незначущі відхилення Клінічно значущі відхилення
Натрій на 3-й день Натрій на початку
Калій на 3-й день Калій на початку
Глюкоза на 3-й день Глюкоза на початку
АлАТ на 3-й день АлАТ на початку
АсАТ на 3-й день АсАТ на початку
Білірубін на 3-й день Білірубін на початку
Креатинін на 3-й день Креатинін на початку
Сечовина на 3-й день Сечовина на початку
У пацієнтів, яким уводився Реосорбілакт, було зафіксовано достовірне зменшення кількості лейкоцитів (із 14,50 (11,00-17,10) до 8,80 (7,09-10,80) ×109/л; р<0,001), лейкоцитарного ІІ (з 5,12 (3,53-9,35) до 2,35 (1,33-4,22); р<0,001), ядерного ІІ (з 0,19 (0,10-0,42) до 0,09 (0,04-0,15); р<0,001) та гематологічного ІІ (з 5,29 (3,55-7,23) до 4,00 (2,54-5,25); р=0,002). Знизився також уміст С-реактивного білка (з 32,70 (17,50-176,00) до 24,00 (9,65-96,00) мг/л; р<0,001). Натомість зросли рівні імуноглобулінів А (з 2,81 (1,63-4,03) до 2,89 (1,89-4,18) г/л), M (з 0,99 (0,60-1,14) до 1,10 (0,79-1,30) г/л) та G (з 11,03 (9,16-12,64) до 11,17 (8,75-15,54) г/л).
Співвідношення нейтрофілів до лімфоцитів зменшилося з 7,28 (4,88-11,00) до 5,33 (3,37-8,45); р=0,014. Ця зміна є дуже важливою, оскільки, за даними літератури, співвідношення віддзеркалює активність двох універсальних патогенетичних механізмів – системного неспецифічного запалення та відповіді імунної системи [21, 22].
Аналіз параметрів газового складу крові виявив статистично достовірне підвищення вмісту стандартного бікарбонату (з 23,23±3,47 до 24,11±5,51 ммоль/л) і надлишку основ (з -1,01±4,31 до 1,44±3,37 ммоль/л) після 3 днів уведення Реосорбілакту, що свідчить про потужний олужнювальний вплив.
Середня ЧСС при надходженні становила 93,15±17,69 уд./хв, а на 3-й день лікування – вже 80,61±11,28 уд./хв (р<0,001). Було зафіксовано невелике, але достовірне підвищення систолічного (зі 120,00 (110,00-130,00) до 120,00 (115,00-130,00) мм рт. ст.; р=0,015) та діастолічного (із 70,00 (60,00-80,00) до 80,00 (70,00-80,00) мм рт. ст.; р<0,001) АТ. Ці зміни можуть виступати свідченням покращення роботи серцево-судинної системи, зокрема збільшення серцевого викиду.
Медіана температури тіла знизилася: з 38,20 (37,00-38,70) до 36,80 (36,70-37,30) °С (р<0,001), що свідчить про виражене зменшення інтоксикаційного синдрому. Сприятливою ознакою є й зменшення частоти дихання, що відзначалося на тлі лікування Реосорбілактом: вихідний показник становив 20,00 (18,00-22,00) за 1 хв, а показник на 3-й день лікування – 18,00 (16,00-20,00) за 1 хв (р<0,001).
За час дослідження НЯ було зареєстровано у 20 пацієнтів (22,47 %). Усього спостерігалися 46 НЯ, 33 з яких характеризувалися легким ступенем тяжкості. Жодне НЯ, в тому числі жодне з двох зафіксованих серйозних НЯ, не було пов’язане із застосуванням Реосорбілакту.
Загалом отримані результати свідчать про те, що препарат Реосорбілакт ефективно забезпечує поліпшення стану пацієнтів, знижуючи вираженість поліорганної недостатності й ендогенної інтоксикації за більшістю оцінених у дослідженні показників у пацієнтів із сепсисом.
Висновки
Наразі питання оптимальної ІТ при сепсисі залишається відкритим. Різнопланові дослідження показують, що тактика агресивної великооб’ємної ІТ поступається тактиці малооб’ємної ІТ з використанням спеціальних поліфункціональних багатокомпонентних розчинів. Зокрема, ІТ за допомогою препарату Реосорбілакт (200-400 мл/добу протягом 3 днів) дає можливість збільшити об’єм циркулювальної крові на тлі зменшення загального об’єму інфузії, необхідної для досягнення терапевтичного ефекту, таким чином усуваючи ризик надмірної гідратації та перевантаження рідиною, що особливо важливо для пацієнтів у критичному стані.
Екзогенний лактат у складі Реосорбілакту не впливає на рівень ендогенного лактату, що доводить відмінний профіль безпеки застосування цього розчину. Виявлені в дослідженні препарату НЯ виявилися не пов’язаними із застосуванням Реосорбілакту. Включення Реосорбілакту в комплекс інтенсивної терапії сприяло зниженню температури, ЧСС і кількості лейкоцитів, які слугують маркерами ендогенної інтоксикації. Застосування Реосорбілакту вже за перші 3 дні інтенсивної терапії забезпечувало зростання показників стандартного бікарбонату та надлишку основ, тобто зменшувало ймовірність розвитку метаболічного ацидозу.
Слід зауважити, що для досягнення отриманих у ході дослідження ефектів Реосорбілакту необхідно дотримуватися відповідної дози, швидкості та кратності введення згідно з інструкцією. Дослідження RheoSTAT-CP0620 обґрунтовує доцільність застосування препарату Реосорбілакт у комплексній терапії сепсису.
Автори:
В.Х. Шаріпова1, С. Берідзе2, О.О. Підмурняк3, Н.А. Шаназаров4, Ю.Ю. Кобеляцький5, В.І. Кошля6, С.Б. Пєєв7,Н. Бабунашвілі8, В. Кожокару9, А. Бєлий10, О.Є. Каніковський11, І. Пирцак12
2 JSC EVEX Medical Corporation / Батумський державний університет ім. Шота Руставелі, Грузія
3 Вінницький національний медичний університет ім. М.І. Пирогова / Хмельницька обласна лікарня, Україна
4 Лікарня Медичного центру Управління справами президента Республіки Казахстан, м. Нур-Султан, Казахстан
5 Дніпровський державний медичний університет, м. Дніпро, Україна
6 ДУ «Запорізька медична академія післядипломної освіти МОЗ України», м. Запоріжжя, Україна
7 ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України», м. Харків, Україна
8 JSC EVEX/LTD – Кутаїська лікарня швидкої допомоги, м. Кутаїсі, Грузія
9 Республіканська клінічна лікарня, м. Кишинів, Молдова
10 Інститут швидкої допомоги, м. Кишинів, Молдова
11 Вінницький національний медичний університет ім. М.І. Пирогова, м. Вінниця, Україна
12 Муніципальна клінічна лікарня «Sfânta Treime», м. Кишинів, Молдова
Література:
- De Backer D., Dorman T. Surviving sepsis guidelines: a continuous move toward better care of patients with sepsis. JAMA. 2017; 317: 807 – 8. doi: 10.1001/jama.2017.0059 .
- Gaieski D.F., Edwards J.M., Kallan M.J., Carr B.G. Benchmarking the incidence and mortality of severe sepsis in the United States. Crit. Care Med. 2013; 41: 1167 – 74. doi : 10.1097/ CCM .0 b 013 e 31827 c 09 f 8 .
- Seymour C . W ., Liu V . X ., Iwashyna T . J ., Brunkhorst F . M ., Rea T . D ., Scherag A ., et al . Assessment of clinical criteria for sepsis: for the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis – 3). JAMA. 2016; 315: 762 – 74. doi: 10.1001/jama.2016.0288 .
- Stevenson E.K., Rubenstein A.R., Radin G.T., Wiener R.S., Walkey A.J. Two decades of mortality trends among patients with severe sepsis: a comparative meta – analysis. Crit. Care Med. 2014; 42: 625 – 31. doi: 10.1097/CCM.0000000000000026 .
- Angus D .C., van der Poll T. Severe sepsis and septic shock. N. Engl. J. Med. 2013; 369: 840 – 51. doi: 10.1056/NEJMra1208623 .
- Adhikari N.K., Fowler R.A., Bhagwanjee S., Rubenfeld G.D. Critical c are and the global burden of critical illness in adults. Lancet. 2010; 376: 1339 – 46. doi: 10.1016/S0140 – 6736(10)60446 – 1 .
- Gupta S., Sakhuja A., Kumar G., McGrath E., Nanchal R.S. , Kashani K.B. Culture – negative severe sepsis: nationwide trends and outcomes. Chest . 2016; 150 (6): 1251 – 9.
- Mayr F.B., Yende S., Angus D.C. Epidemiology of severe sepsis. Virulence . 2014; 5 (1): 4 – 11.
- Nannan Panday R.S., Lammers E.M.J., Alam N., Nan ayakkara P.W.B. An overview of positive cultures and clinical outcomes in septic patients. Crit. Care . 2019; 23 (1): 182. doi: 10.1186/s13054 – 019 – 2431 – 8.
- Seymour C.W., Gesten F., Prescott H.C., Friedrich M.E., Iwashyna T.J., Phillips G.S., et al. Time to treatment and mortality during mandated emergency care for sepsis. N. Engl. J. Med . 2017; 376 (23): 2235 – 2244. doi: 10.1056/NEJMoa1703058.
- Levy M.M., Evans L.E., Rhodes A. The surviving sepsis campaign bundle: 2018 update. Intensive Care Med . 2018; 44 (6): 925 – 928.
- Bansal M., Farrugia A., Balboni S., et al. Relative survival benefit and morbidity with fluids in severe sepsis. Curr. Drug Saf . 2013; 8 (4): 236 – 45.
- Sterling S.A., Miller W.R., Pryor J., et al. The impact of timing of antibi otics on outcomes in severe sepsis and septic shock: a systematic review and meta – analysis. Crit. Care Med . 2015; 43 (9): 1907 – 15.
- Byrne L., Van Haren F. Fluid resuscitation in human sepsis: time to rewrite history? Ann. Intensive Care. 2017; 7: 4. doi : 10.1186/s13613 – 016 – 0231 – 8.
- Maitland K., Kiguli S., Opoka R.O., Engoru C., Olupot – Olupot P., Akech S.O., et al. Mortality after fluid bolus in African children with severe infection. N. Engl. J. Med. 2011; 364: 2483 – 95. doi: 10.1056/NEJMoa1101549.
- Andrews B., Semler M.W., Muchemwa L., Kelly P., Lakhi S., Heimburger D.C., et al. Effect of an early resuscitation protocol on in – hospital mortality among adults with sepsis and hypotension: a randomized clinical trial. JAMA. 2017; 318: 1233 – 40. 10.1001/j ama.2017.10913].
- Boyd J.H., Forbes J., Nakada T.A., Walley K.R., Russell J.A. Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit. Care Med. 2011; 39: 259 – 65. 10.1097/CCM.0b013e3181feeb15.
- Dugar S., Choudhary C., Duggal A. Sepsis and septic shock: guideline – based management. Cleveland Clinic Journal of Medicine. 2020; 87 (1): 53 – 64. doi: https://doi.org/10.3949/ccjm.87a.18143.
- Singer M., Deutschman C.S., Seymour C.W., Shankar – Hari M., Annane D., Bellomo R., et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis – 3). JAMA. 2016; 315: 801 – 10. doi: 10.1001/jama.2016.0287 .
- Marik P.E., Byrne L., van Haren F. Fluid resuscitation in sepsis: the great 30 mL per kg hoax. J. Thorac. Dis . 2020; 12 (Suppl. 1): S37 – S47. doi: 10.21037/jtd.2019.12.84.
- Ozyilmaz S., Akgul O., Uyarel H., Pusuroglu H., Gul M., Satilmisoglu M., et al. The importance of the neutrophil – to – lymphocyte ratio in patients with hypertrophic cardiomyopathy. Rev. Port. Cardiol. 2017; 36 (4): 239 – 46. doi: 10.1016/j.repc.2016.09.014.
- Balta S., Celik T., Mikhailidis D.P., Ozturk C., Demirkol S., Aparci M., et al. The relation between atherosclerosis and the neutrophil – lymphocyte ratio. Clin. Appl. Thromb. Hemost. 2016; 22 (5): 405 – 11. doi: 10.1177/1076029615569568.
- Rhodes A., Evans L.E., Alhazzani W., Levy M.M., A ntonelly M., Ferrer R., et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock: 2016. Crit. Care Med . 2017; 45 (3): 486 – 552. doi: 10.1097/CCM.0000000000002255.
- Dellinger R.P., Schorr C.A., Levy M.M. A users ’ guide to the 2016 surviving sepsis guidelines. Crit. Care Med . 2017; 45 (3): 381 – 385.
- Avni T., Lador A., Lev S., Leibovici L., Paul M., Grossman A. Vasopressors for the treatment of septic shock. PLoS One . 2015; 10 (8): e0129305. doi: 10.1371/journal .pone.012930.
- Angus D.C., Barnato A.E., Bell D., Bellomo R., Chong C. – R., Coats T.J., et al. A systematic review and meta – analysis of early goal – directed therapy for septic shock: the ARISE, ProCESS and ProMISe Investigators. Intensive Care Med. 2015; 41: 1549 – 60. 10.1007/s00134 – 015 – 3822 – 1.
- Vandervelden S., Malbrain M.L. Initial resuscitation from severe sepsis: one size does not fit all. Anaesthesiol. Intensive Ther. 2015; 47: s44 – 55. 10.5603/AIT.a2015.0075.
- Hendershot K.M., Robinson L., Roland J., Vaziri K., Rizzo A.G., Fakhry S.M. Estimated height, we ight and body mass index: implications for research and patient safety. J. Am. Coll. Surg. 2006; 203: 887 – 93. 10.1016/j.jamcollsurg.2006.08.018.
- Maskin L.P., Attie S., Setten M., Rodriguez P.O., Bonelli I., Stryjewski M.E., et al. Accuracy of weight an d height estimation in an intensive care unit. Anaesth. Intensive Care. 2010; 38: 930 – 4. 10.1177/0310057X1003800519.
- Bloomfield R., Steel E., MacLennan G., Noble D.W. Accuracy of weight and height estimation in an intensive care unit: implications for clinical practice and research. Crit. Care Med. 2006; 34: 2153 – 7. 10.1097/01.CCM.0000229145.04482.93.
- van Haren F . Personalised fluid resuscitation in the ICU: still a fluid concept? Crit. Care. 2017; 21: 313. doi: 10.1186/s13054 – 017 – 1909 – 5].
- Ognibene F.P., Parker M.M., Natanson C., Shelhamer J.H., Parrillo J.E. Depressed left ventricular performance. Response to volume infusion in patients with sepsis and septic shock. Chest. 1988; 93: 903 – 10. 10.1378/chest.93.5.903.
- Prowle J.R., Kirwan C.J., Bellomo R. Fluid management for the prevention and attenuation of acute kidney injury. Nat. Rev. Nephrol. 2014; 10: 37 – 47. doi: 10.1038/nrneph.2013.232.
- Hilton A.K., Bellomo R. A critique of fluid bolus resuscitation in severe sepsis. Crit. Care. 2012; 16: 302. doi: 10.1186/cc11154.
- Silversides J.A., Perner A., Malbrain M. Liberal versus restrictive fluid therapy in critically ill patients. Intensive Care Med. 2019; 45: 1440 – 2. doi: 10.1007/s00134 – 019 – 05713 – y.
- Awad S., Allison S.P., Lobo D.N. The history of 0.9 % saline. Clin . Nutr . Edinb . Scotl . 2008; 27: 179 – 88.
- Кондрацкий Б., Новак В. Опыт применения в клинической практике комплексного инфузионного препарата Реосорбилакт. Мистецтво лікування . 2006; 1: 34 – 36.