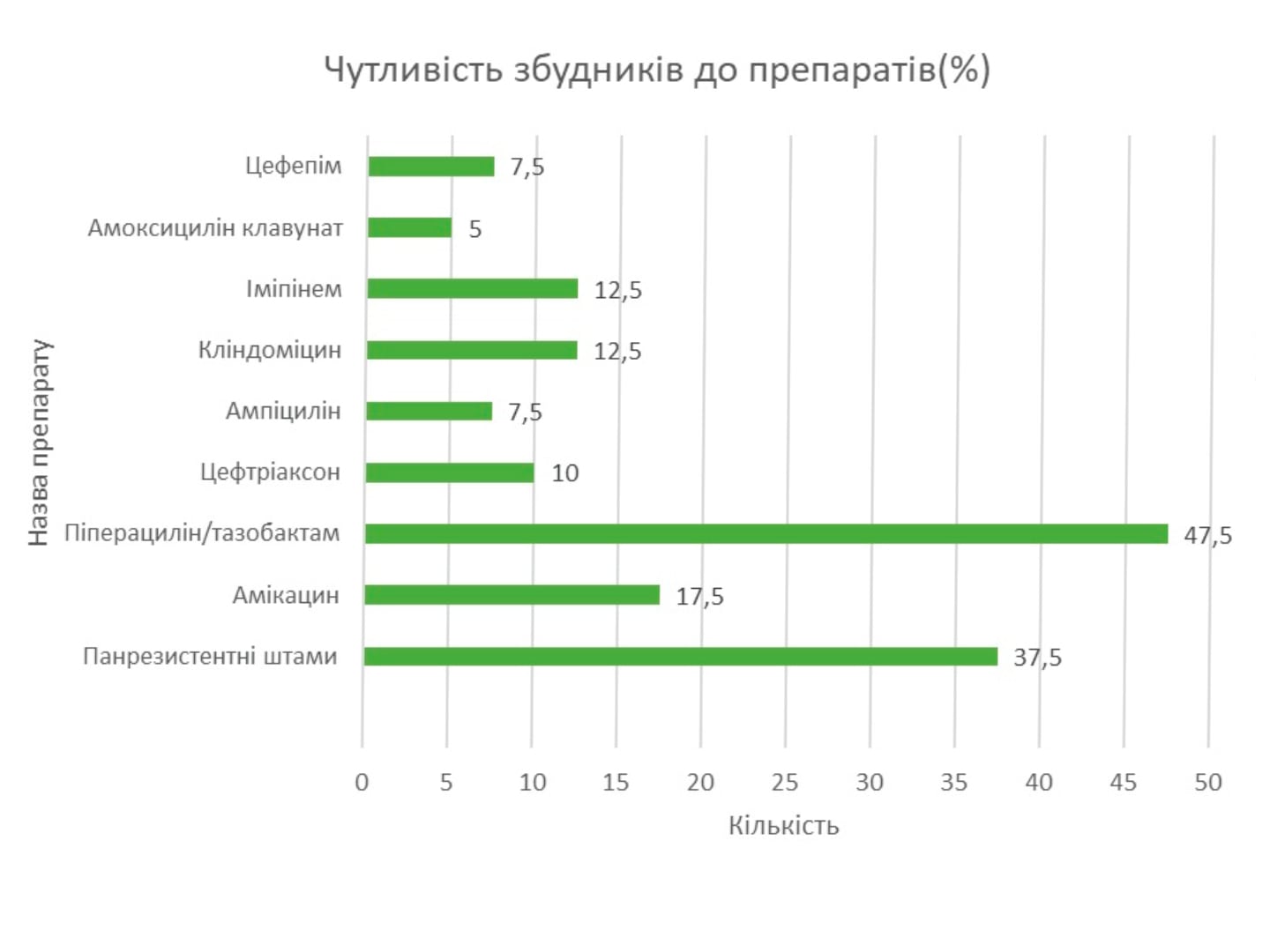
Перші дані про результати міжнародного багатоцентрового клінічного дослідження RheoSTAT-CP0669 щодо ефективності та безпеки інфузійного розчину Реосорбілакт® у комплексному лікуванні пацієнтів з опіковою хворобою

Резюме
Механізація й урбанізація супроводжуються зростанням поширеності опіків. Опік спричиняє й локальне пошкодження, й системну запальну відповідь, яка призводить до неадекватної доставки кисню до життєво важливих органів і неповноцінної елімінації метаболітів.
Інфузійна терапія опіків має на меті відновлення перфузії та профілактику ішемії. Впровадження ефективних динамічних схем інфузійної терапії сприяло зменшенню смертності, проте надмірна кількість уведеної рідини не покращує волюметричний статус пацієнта, натомість посилює набряк тканин і спричиняє низку ускладнень. Тому перед лікарями постає питання підбору оптимальної інфузійної терапії, яка дасть змогу підтримувати статус пацієнта на рівні золотої середини – нормоволемії.
Як свідчать результати відкритого із засліпленою оцінкою рандомізованого контрольованого дослідження RheoSTAT-СР0669, уведення пацієнтам з опіковою хворобою Реосорбілакту шляхом внутрішньовенної інфузії в дозі 200-400 мл/добу впродовж 3 днів значно покращує клінічний стан, зменшує прояви (полі-)органної недостатності й ендогенної інтоксикації.
Малооб’ємна інфузійна терапія Реосорбілактом сприяє статистично значущому зменшенню частоти дихання, зниженню ендогенної інтоксикації й інтенсивності запалення, а також позитивній динаміці газового складу крові.
Введення препарату в такому режимі має сприятливий профіль безпеки: не призводить до перевантаження рідиною, асоційованих із ним ускладнень або інших серйозних небажаних побічних ефектів і не спричиняє клінічно значущого підвищення лактату крові.
Дослідження RheoSTAT-СР0669 обґрунтовує доцільність застосування препарату Реосорбілакт у комплексній терапії опіків.
Ключові слова: опікова хвороба, інфузійна терапія, Реосорбілакт.
Конфлікт інтересів: відсутній.
Стаття
Стала механізація й урбанізація суспільства супроводжуються зростанням поширеності опіків. За оцінками Всесвітньої організації охорони здоров’я, у світі щорічно відбувається близько 11 млн опіків різного типу, 180 тис. з яких є фатальними. Сучасні заходи профілактики та лікування опіків дали змогу значно зменшити смертність від цього патологічного стану, проте рівень інвалідизації продовжує залишатися високим [1, 2]. Опіковій хворобі притаманний специфічний патогенез, який поєднує гіповолемію, ушкодження клітин і мікроваскулярні та гемодинамічні зміни.
Опік спричиняє не лише значне локальне пошкодження, а й інтенсивну системну запальну відповідь, у ході якої вивільняються запальні й вазоактивні медіатори (гістамін, простагландини, цитокіни) та збільшується проникність судин як ушкоджених, так і здорових тканин. Ця підвищена проникність провокує вихід рідини з інтраваскулярного в інтерстиційний простір, що призводить до набряків, гіповолемії та гемоконцентрації. Безумовно, це зумовлює неадекватну доставку кисню до життєво важливих органів і неповноцінну елімінацію метаболітів [3]. Суттєві зсуви рідинного балансу в організмі відбуваються переважно в перші 24 години з моменту опіку, досягаючи пікових значень через 6-8 годин після ушкодження.
Така патофізіологічна реакція в поєднанні зі зниженням серцевого викиду та підвищенням загального судинного опору може спричинити опіковий шок [4, 5]. Опіковий шок поєднує характеристики гіповолемічного, кардіогенного та перерозподільного (дистрибутивного) шоку; виникає в перші 48 годин після опіку внаслідок надмірної запальної відповіді й характеризується дифузним підвищенням проникності капілярів. При такому шоку втрати білків, електролітів і плазми через стінку капілярів призводять до зменшення інтраваскулярного об’єму, погіршення перфузії внутрішніх органів і розвитку дизоксії клітин – порушення метаболізму кисню на клітинному рівні [6].
Інфузійна терапія (ІТ) опіків розпочалася 100 років тому, коли Underhill і співавт. (1921) досліджували стан жертв пожежі в театрі Ріальто в м. Нью-Гейвен (США) та з’ясували, що склад вмісту опікового пухиря ідентичний складу плазми крові. Подальшими роками дослідження фокусувалися на необхідному складі й об’ємі інфузійного розчину (ІР) [5]. На початках дослідження застосовували переважно ІТ із попередньо встановленими цілями (серцевим індексом, внутрішньогрудним об’ємом крові), натомість нині перевагу віддають індивідуалізованому підходу, в рамках якого цілі встановлюють індивідуально для кожного пацієнта з урахуванням його коморбідних станів і функції органів [7].
Основною метою ІТ у разі термічної травми є збереження й відновлення перфузії та профілактика ішемії, але досягнення цієї мети ускладнено набряком і трансваскулярним переміщенням рідини, притаманним опікам [5]. Упровадження ефективних динамічних схем ІТ сприяло зменшенню смертності в перші 24-48 годин. Коли ж ІТ є неоптимальною, глибина опіку зростає, а шоковий період є довшим, що призводить до більшої смертності [5].
У сучасній парадигмі опік розглядають як чотиривимірне ураження тіла, причому четвертим виміром виступає час. Неналежна ІТ упродовж першої доби після термічного ураження може призвести до значного збільшення обсягу опікової травми; це пов’язано з тим, що зону некрозу оточує зона стазу зі сповільненим кровоплином. За відсутності корекції цього сповільнення зона стазу може трансформуватися в зону некрозу [8].
Раніше провідною причиною смерті від опікового шоку виступала гіповолемія, проте впровадження готових ІР у широку практику за умови неоптимального застосування почало, навпаки, зумовлювати гіперволемію, яка збільшувала кількість небажаних ефектів і показник смертності. Проблема перевантаження рідиною в ході ІТ широко обговорюється в літературі впродовж останніх років.
Надмірна кількість уведеної рідини не покращує волюметричний статус пацієнта, натомість посилює набряк тканин і спричиняє низку ускладнень. Серед останніх можна назвати набряк легень і абдомінальний компартмент-синдром, смертність від якого перевищує 80 %. Унаслідок гіперволемії та збільшення абдомінального набряку зростає внутрішньочеревний тиск, погіршується кровоток у нижній порожнистій вені й, відповідно, серцевий викид. Паралельно зменшується об’єм виділеної сечі та знижується функція легень, що в поєднанні швидко зумовлює погіршення стану пацієнта [7].
Отже, перед лікарями та науковцями постає питання підбору оптимальної ІТ, яка дасть змогу підтримувати статус пацієнта на рівні золотої середини – нормоволемії. Подальше вивчення та вдосконалення схем уведення ІР допоможе додатково зменшити смертність пацієнтів і скоротити час стаціонарного лікування. Нами було висловлено гіпотезу, що застосування ІР Реосорбілакт у дозі 200-400 мл/добу дасть змогу досягти належних цілей ІТ у разі опіків, не спричиняючи при цьому гіперволемії.
Мета: встановити ефективність і безпеку Реосорбілакту для лікування пацієнтів з опіковою хворобою з огляду на клінічні дані дослідження RheoSTAT-CP0669 із метою подальшого внесення в рекомендації щодо лікування таких пацієнтів.
Матеріали та методи
Здійснено електронний пошук у базах даних PubMed, MEDLINE та Cochrane Library за останні 20 років із використанням чутливої стратегії без мовних обмежень за такими ключовими словами: «опіки», «опікова хвороба», «опіковий шок», «рідинна терапія», «рідинна ресусцитація», «вибір ІР», «рандомізоване контрольоване дослідження», «огляд», «метааналіз».
Проведено також огляд результатів післяреєстраційного міжнародного багатоцентрового відкритого із засліпленою оцінкою кінцевих точок ефективності рандомізованого контрольованого дослідження (РКД) IV фази RheoSTAT на підставі звіту, наданого компанією «Юрія-Фарм». Дослідження тривало з 03.12.2017 до 12.05.2021, здійснювалося контрактною дослідною організацією відповідно до принципів Належної клінічної практики (ICH GCP), етичних норм Гельсінкської декларації Всесвітньої медичної асоціації та національних стандартів і внесене до Кокранівської бібліотеки [9], однієї з найавторитетніших електронних баз даних із доказової медицини, що вказує на високий рівень доказовості.
Загалом РКД RheoSTAT включало 629 пацієнтів із сепсисом, перитонітом, опіковою хворобою та пневмонією, котрі лікувалися в 37 клінічних центрах 6 країн. У субдослідженні RheoSTAT-CP0669 брали участь 118 пацієнтів із 8 клінічних центрів 5 країн – України, Молдови, Грузії, Узбекистану та Казахстану.
До субдослідження RheoSTAT-CP0669 було включено дорослих хворих (18-60 років) із верифікованим діагнозом «опікова хвороба», що відповідали таким критеріям: 1) вік від 18 до 60 років включно; 2) термічні ураження 2-го ступеня загальною площею щонайменше 20 % і не більш ніж 45 % поверхні тіла (допускалося включення пацієнтів із глибокими опіками, що становлять від 3 до 15 % поверхні тіла в поєднанні як з поверхневими опіками, так і з ізольованими); 3) тяжкість стану за індексом Франка від 30 до 90 одиниць; 4) давність отриманої термічної травми не більш ніж 3 доби від запланованого першого введення препарату; 5) власноруч підписана пацієнтом інформована згода на участь у дослідженні.
Пацієнтів було рандомізовано в основну групу (n=57) та групу контролю (n=61). Середній вік учасників основної групи становив 40,9±12,06 року, групи порівняння – 39,31±10,631 року (статистично значущих відмінностей між групами не виявлено, р=0,399). Більшість пацієнтів були європеоїдної раси: 80,7 % в основній групі та 77,0 % у групі порівняння (р=0,628).
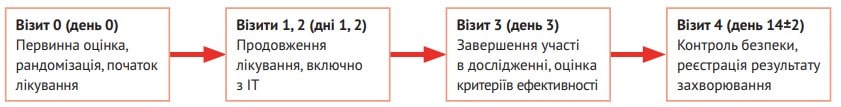
Більшість обох груп становили чоловіки (70,2 % основної групи та 73,8 % групи порівняння, р=0,664). Учасники основної групи впродовж 3 днів отримували ІР Реосорбілакт® шляхом внутрішньовенної інфузії в дозі 200-400 мл/добу. На 3-й день у них оцінювали критерії ефективності, а через 14±2 дні контролювали безпеку та наслідки хвороби (рис. 1).
Рис. 1. Схема дизайну дослідження RheoSTAT-CP0669
Оцінка ефективності та безпеки досліджуваного препарату здійснювалася на підставі численних оцінювальних шкал і клініко-лабораторних показників, указаних у таблиці 1.
Таблиця 1. Критерії оцінки ефективності та безпеки в дослідженні RheoSTAT-CP0669

Результати та їх обговорення
Початкова ІТ ґрунтується на застосуванні кристалоїдів. Хоча показано, що цим розчинам притаманна менша експансія об’єму плазми, ніж колоїдам [10], у зв’язку з підвищеною проникністю капілярів у перші 24 години після опіку колоїди проникають у позасудинний простір, реалізують онкотичний ефект і парадоксально збільшують так званий третій простір, тобто об’єм інтерстиційної рідини [11].
Наразі кристалоїдні розчини вважаються недорогими, загальнодоступними та перевіреними часом засобами для ІТ. Натомість колоїдні ІР є дороговартісними, а їх однозначної переваги над кристалоїдами не доведено [12]. Перелічені вище властивості кристалоїдів надзвичайно важливі для громадського здоров’я, оскільки роблять застосування цієї групи розчинів економічно доцільним. Однозначно доведено, що збалансовані розчини мають перевагу над незбалансованими кристалоїдами (рівень доказовості 1B) [13].
Кристалоїдні розчини являють собою підвид ІР, що є засобом першого вибору для ІТ у разі гіповолемії, кровотечі, сепсису та дегідратації. Крім того, кристалоїди застосовуються для внутрішньовенної доставки необхідних медикаментів, підтримки балансу рідини в пацієнтів із відсутнім/обмеженим ентеральним харчуванням, контролю артеріального тиску та підвищення діурезу. За хімічною природою кристалоїди являють собою водні розчини мінеральних солей та інших малих водорозчинних молекул.
Більшість кристалоїдів є ізотонічними плазмі крові людини, тому не чинять осмотичного ефекту in vivo, не порушують концентрації іонів у плазмі та не призводять до істотних зсувів балансу рідини між внутрішньоклітинним, внутрішньосудинним й інтерстиційним просторами. Особливо ефективними є буферизовані розчини, що містять молекули, здатні in vivo метаболізуватися до бікарбонату, як-от лактат. Ці розчини були створені для підтримки нормального фізіологічного pH плазми крові [14].
Досліджуваний препарат Реосорбілакт® являє собою ІР, який містить сорбітол, лактат натрію, натрію хлорид, кальцію хлорид, калію хлорид і магнію хлорид. Це клінічне дослідження було заплановано та проведено з метою доведення вищої ефективності та зіставної безпеки препарату Реосорбілакт® у лікуванні пацієнтів з опіковою хворобою. Вибраний дизайн дослідження – рандомізоване порівняльне в паралельних групах багатоцентрове із засліпленою оцінкою – відповідав поставленим цілям і давав змогу мінімізувати систематичні помилки відбору в дослідження й оцінки результатів.
Оскільки пацієнтам з опіковою хворобою притаманний досить високий ризик розвитку сепсису, як первинний критерій ефективності терапії була обрана зміна загального бала за шкалою SOFA на день 3 порівняно з вихідним значенням під час включення в дослідження, розрахована як різниця середніх показників (значення показника на момент включення в дослідження за вирахуванням значення показника наприкінці лікування).
Як вторинні критерії оцінки ефективності використовувалися шкали APACHE II, SAPS II та Spronk, а також широкий спектр біохімічних маркерів, імунологічних критеріїв й інтегральних показників тяжкості ендогенної інтоксикації, характерної для пацієнтів з опіковою хворобою. До популяції intention-to-treat (ITT) було включено 55/57 (96,49 %) пацієнтів основної групи, а до популяції безпеки – всі рандомізовані пацієнти.
При включенні в дослідження середнє значення (± стандартне відхилення) за шкалою SOFA в основній групі становило 2±1,472 бала, а на 3-й день – 2,2±1,421 бала. За шкалою SAPS II відповідні значення дорівнювали 15,09±5,400 та 14,73±5,230 бала. Спостерігалося також зменшення бальної оцінки за шкалою Spronk: із 0,31±2,103 до 0,18±0,964 бала. Вибір шкали Spronk (табл. 2) на додаток до неспецифічних шкал оцінки тяжкості стану хворих був обумовлений тим, що вона є основною для оцінки стану хворих з опіковою хворобою й опіковим шоком згідно з клінічними рекомендаціями «Діагностика та лікування опікового шоку».
Таблиця 2. Шкала за P.E. Spronk і співавт. (2005) [15]

Середнє значення (± стандартне відхилення) за шкалою APACHE II при включенні в дослідження становило 6,85±3,654 бала, а на 3-й день – 5,87±3,873 бала, що відповідає середній зміні оцінки на 0,98±2,765 бала порівняно з вихідним рівнем і свідчить про зменшення тяжкості стану пацієнтів (рис. 2).
Рис. 2. Динаміка бальної оцінки за шкалою APACHE II
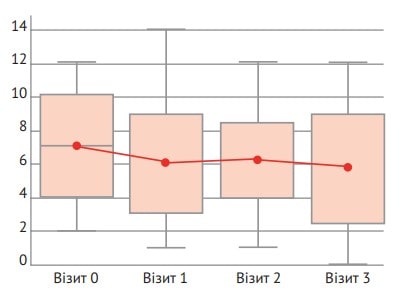
Слід зауважити, що саме шкала APACHE II (Acute Physiology and Chronic Health Evaluation) уже понад 30 років виступає еталоном прогнозування смертності в пацієнтів у критично тяжкому стані [16], що зумовлює вагомість отриманого результату. Незважаючи на наявність новіших модифікацій APACHE III й APACHE IV, найвикористовуванішою системою для оцінки тяжкості хвороби пацієнтів у відділеннях інтенсивної терапії в усьому світі залишається саме APACHE II [17]. Когортне дослідження R. Martynoga та M. Fried (2009) дало змогу валідувати цю шкалу в пацієнтів з опіками: відповідно до аналізу, проведеного методом логістичної регресії, оцінка за шкалою APACHE II виступала незалежним предиктором смертності в цих хворих [18].
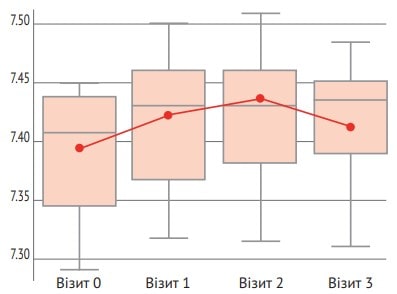
Завдяки оцінці вторинних параметрів ефективності було виявлено статистично значущу перевагу (р=0,043) в основній групі порівняно з контрольною групою за показником рН крові (рис. 3).
Рис. 3. Динаміка рН крові
При додатковому аналізі змін параметрів на день 3 порівняно з вихідним рівнем з’ясувалося, що на тлі триденної терапії Реосорбілактом спостерігається статистично значуща зміна життєво важливих показників (а саме зниження середніх значень частоти дихання); зниження вираженості ендогенної інтоксикації, що оцінюється за біохімічними (концентрація загального білірубіну, альбумінова фракція), імунологічними (рівень лейкоцитів, лейкоцитарний і гематологічний ІІ) показниками, а також покращення показників газового складу крові (підвищення стандартних бікарбонатів) (табл. 3). Відповідно до оцінки клінічних ознак, під час включення в дослідження слабкість реєструвалася у 36 із 55 пацієнтів в основній групі, а на день 3 – лише у 12 із 55 пацієнтів.
Таблиця 3. Оцінка ефективності Реосорбілакту до та після терапії
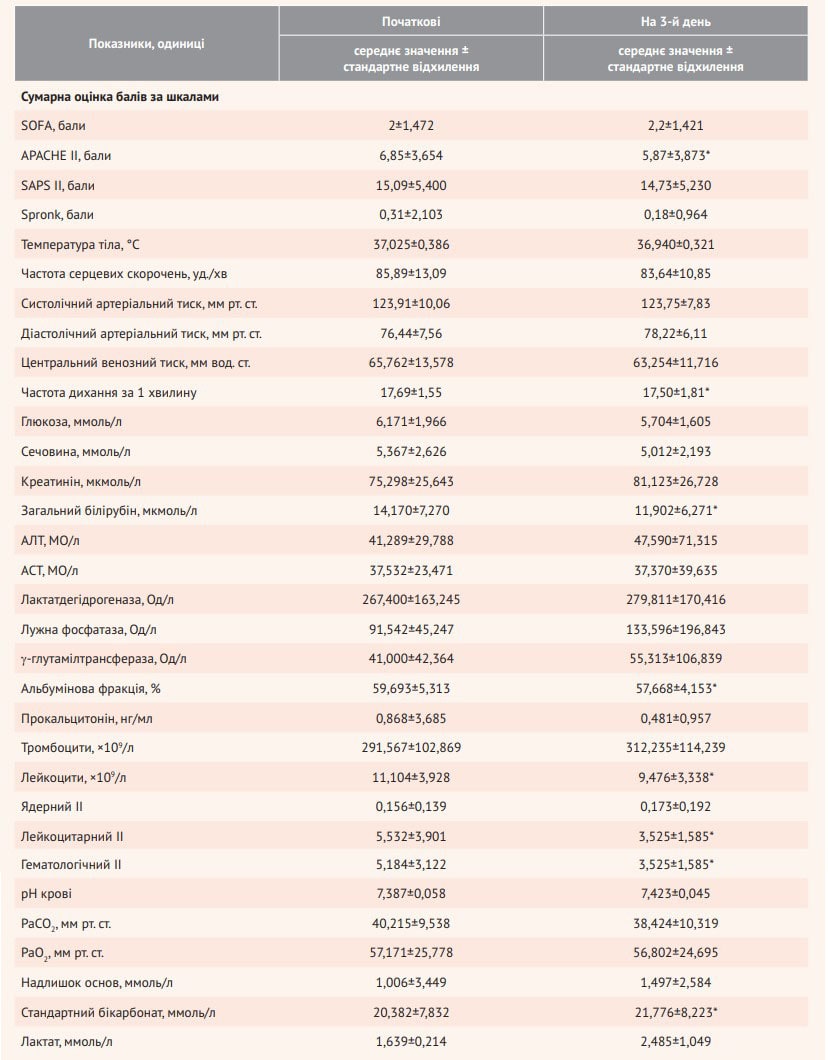
Примітки: дані отримано зі звіту про результати РКД RheoSTAT-CP0669, наданого компанією «Юрія-Фарм»; * статистично значуща зміна.
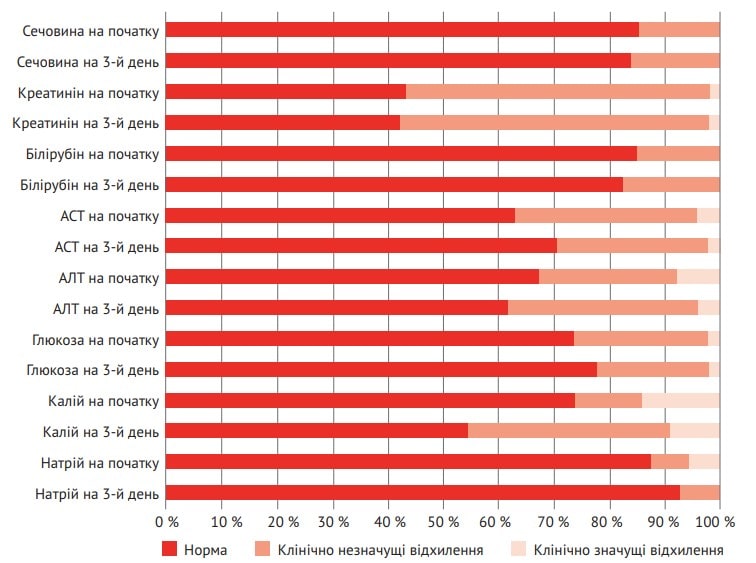
Варто зауважити, що вже на 3-й день терапії в учасників основної групи виявлено зменшення відсотка відхилень деяких лабораторних показників функції елімінаційних органів, рівнів глюкози й електролітів крові, в тому числі клінічно значущих (рис. 4).
Рис. 4. Відсоток відхилень показників функції елімінаційних органів, глюкози й електролітів крові до та після 3-денного курсу лікування Реосорбілактом
На тлі застосування Реосорбілакту відзначалися лише 2 випадки НЯ (1,8 % пацієнтів; обидва випадки – легкого ступеня тяжкості), які було визнано не пов’язаними з досліджуваним препаратом. Один випадок було класифіковано як серйозне НЯ, котре також не було пов’язане із застосуванням Реосорбілакту. Отже, згідно з результатами аналізу безпеки Реосорбілакт® має прийнятний профіль безпеки.
Слід зазначити, що застосування Реосорбілакту викликало тенденцію до нормалізації температури та частоти серцевих скорочень. На тлі ІТ Реосорбілактом достовірно знижувалася частота дихання та зростав уміст стандартного бікарбонату, що свідчить про залужнення крові. Натомість уміст лактату залишався без достовірних змін. Це надзвичайно важливо, оскільки лактат крові входить до найважливіших показників, які підлягають моніторуванню в пацієнта з опіками поряд із частотою пульсу, артеріальним тиском, сатурацією крові киснем, рН артеріальної крові, дефіцитом основ, центральним венозним тиском, серцевим індексом тощо [8].
Однією з вагомих патогенетичних ланок ушкодження органів і систем у разі опіків виступає розвиток ендогенної інтоксикації та запальної реакції. У відповідь на локальне термальне ушкодження клітин вивільняється низка запальних медіаторів і цитокінів, які беруть участь у системній запальній відповіді. Отже, в крові різко зростає кількість пептидів середньої молекулярної маси, яким притаманні системні цитотоксичні властивості [19].
Одним із маркерів ендогенної інтоксикації є загальний білірубін; для оцінки її вираженості використовуються також ІІ (гематологічний, лейкоцитарний, ядерний). У пацієнтів, яким проводилися інфузії Реосорбілакту, спостерігалося достовірне зниження загального білірубіну, а також лейкоцитарного та гематологічного ІІ. Крім того, відзначалося достовірне зменшення кількості лейкоцитів з 11,104±3,928 до 9,476±3,338×109/л, що відображає різке зниження інтенсивності запалення.
Для серцево-судинної підтримки необхідно розпочати ІТ одразу після оцінювання стану пацієнта. Кожна додаткова година від моменту опіку до початку ІТ підвищує показники смертності [20]. Недостатня ІТ може призвести до гіпоперфузії тканин, гострого ушкодження нирок і смерті. З іншого боку, надмірна ІТ здатна спричинити набряк тканин, компартмент-синдроми, гострий респіраторний дистрес-синдром, пневмонію та поліорганну недостатність.
Тому належна ІТ пацієнтів комбустіологічного профілю потребує індивідуального підбору дози ІР і ретельного моніторингу стану хворих із метою уникнення вторинних ятрогенних ушкоджень [21]. Для досягнення бажаних ефектів Реосорбілакту ключове значення має дотримання відповідної дози, швидкості та кратності введення.
Автори:
- Нагайчук Василь Іванович, Вінницька обласна клінічна лікарня ім. М.І. Пирогова, Україна
- Козинець Георгій Павлович, Київська міська клінічна лікарня №2, Україна
- Шаріпова Вісолат Хамзаївна, Республіканський Центр Екстреної Медичної Допомоги, Узбекистан
- Чиримпей О., Республіканська клінічна лікарня Травматології та Ортопедії, Молдова
- Тулеубаєв Б., Карагандинський державний медичний університет, кафедра загальної хірургії та травматології на базі “ОЦТО ім. Х.Ж. Макажанова”, Казахстан
Висновки:
- Малооб’ємна ІТ Реосорбілактом у дозі 200-400 мл/добу дає змогу зменшити загальний об’єм інфузії, потрібної для досягнення терапевтичного ефекту, без ризику гіпергідратації та перевантаження рідиною, що особливо важливо для пацієнтів у критичних станах.
- Екзогенний лактат у складі препарату Реосорбілакт® не впливає на рівень ендогенного лактату, що доводить високий ступінь безпеки застосування розчину.
- У комплексі інтенсивної терапії введення Реосорбілакту сприяло покращенню стану пацієнтів (за шкалою APACHE II), підвищенню рН крові, зменшенню середнього показника частоти дихання, зниженню вираженості ендогенної інтоксикації, позитивній динаміці газового складу крові.
- Реосорбілакт підтвердив свій відмінний профіль безпеки, оскільки частота виявлення побічних ефектів становила лише 1,8 %.
Література:
- World Health Organization. Burns. 2018. Available at: www.who.int/en/news-room/fact-sheets/detail/burns.
- Xiuni Z., Yuan L., Xiaohong D., Chengsong D., Yunfeng P., Ailing H. The correlation between quality of life and acceptability of disability in patients with facial burn scars. Frontiers in Bioengineering and Biotechnology. 2019; 7: 329. doi: 10.3389/fbioe.2019.00329.
- van Zuijlen P.P.M., Korkmaz H.I., Sheraton V.M., Haanstra T.M., Pijpe A., de Vries A., van der Vlies C.H., et al. The future of burn care from a complexity science perspective. Journal of Burn Care & Research. 2022; 029. doi:1093/jbcr/irac029.
- Schaefer T.J., Lopez O.N. Burn resuscitation and management. Treasure Island (FL): StatPearls Publishing, 2022.
- Guilabert P., Usúa G., Martín N., Abarca L., Barret J.P., Colomina M.J. Fluid resuscitation management in patients with burns: update. J. Anaesth. 2016; 117 (3): 284-96. doi: 10.1093/bja/aew266. PMID: 27543523.
- Jeschke M.G., van Baar M.E., Choudhry M.A., et al. Burn injury. Rev. Dis. Primers. 2020; 6: 11. doi: 10.1038/s41572-020-0145-5.
- Boehm D., Menke H. A history of fluid management – from “one size fits all” to an individualized fluid therapy in burn resuscitation. 2021; 57 (2): 187. doi: 10.3390/medicina57020187.
- Diver A.J. The evolution of burn fluid resuscitation. International Journal of Surgery. 2008; 6 (4): 345-350. doi: 10.1016/j.ijsu.2008.02.003.
- Efficacy and safety of Rheosorbilact® solution for infusion, in a complex therapy of burns. NCT04152096. Cochrane Central Register of Controlled Trials (CENTRAL). Issue 11. Available at: clinicaltrials.gov/ct2/show/NCT04152096.
- Orbegozo Cortés D., Gamarano Barros T., Njimi H., Vincent J.L. Crystalloids versus colloids: exploring differences in fluid requirements by systematic review and meta-regression. Analg. 2015; 120: 389-402. doi: 10.1213/ane.0000000000000564.
- Myburgh J.A., Mythen M.G. Resuscitation fluids. Engl. J. Med. 2013; 369: 1243-51. doi: 10.1056/NEJMra1208627.
- Gupta A.K., Asirvatham E., Reddy K., Lamba S. Fluid resuscitation in adult burns. Current Medical Issues. 2021; 19 (2): 103-109. doi: 10.4103/cmi.cmi_137_20.
- Soni N., Powell-Tuck J., Gosling P., Lobo D.N. British consensus guidelines on intravenous fluid therapy for adult surgical patients (GIFTASUP): Cassandra’s view. 2009; 64: 13-15. doi: 10.1111/j.1365-2044.2009.05886_1.x.
- Spronk P.E., Faber D.F., Rommes J.H. Effects of autotransfusion on microvascular perfusion using passive leg-raising in patients with septic shock. Chest J. 2005; 128 (4): 327S. doi: 10.1378/chest.128.4_MeetingAbstracts.376S-b.
- Epstein E.M., Waseem M. Burn resuscitation and management. Treasure Island (FL): StatPearls Publishing, 2022.
- Knaus W.A., Draper E.A., Wagner D.P., Zimmerman J.E. APACHE II: a severity of disease classification system. Care Med. 1985; 13 (10): 818-29.
- Luo Y., Wang Z., Wang C. Improvement of APACHE II score system for disease severity based on XGBoost algorithm. BMC Med. Inform. Decis. Mak. 2021; 21: 237. doi: 10.1186/s12911-021-01591-x.
- Martynoga R., Fried M. APACHE II score may predict mortality in burns patients. Care. 2009; 13: P504. doi: 10.1186/cc7668.
- Bulko I.V. Development endogenous intoxication in thermal skin burns. Natural Science Readings. 2017: 22-23.
- Wolf S.E., Rose J.K., Desai M.H., Mileski J.P., Barrow R.E., Herndon D.N. Mortality determinants in massive pediatric burns. An analysis of 103 children with > or = 80 % TBSA burns (> or = 70 % full-thickness). Surg. 1997; 225 (5): 554-65. doi: 10.1097/00000658-199705000-00012.
- Sojka J., Krakowski A.C., Stawicki S.P. Burn shock and resuscitation: many priorities, one goal. In: Stawicki S.P., Swaroop M., editors. Clinical management of shock – The science and art of physiological restoration. London: IntechOpen, 2019. Available at: www.intechopen.com/chapters/67415. doi: 10.5772/intechopen.85646.