Шлях до індивідуалізації інфузійної терапії невідкладних станів згідно концепції ROSE

Анотація
Стаття присвячена ролі внутрішньовенної рідинної терапії в умовах порушення гомеостазу рідин, що часто виникають під час великих хірургічних втручань і критичних станів, таких як сепсис і травми. Описується важливість адекватного введення рідин для підтримки клітинного гомеостазу, а також керування станами, що пов’язані з гіповолемією та гемодинамічними порушеннями. Зазначається, що, незважаючи на численні дослідження, тема оптимальних стратегій використання рідин залишається дискусійною, з потенційними ризиками негативного впливу надмірного введення рідин на клінічні результати.
Представлено концепцію рідинної ресусцитації ROSE, яка включає чотири етапи: ресусцитація, оптимізація, стабілізація та евакуація. Ця концепція допоможе лікарям у прийнятті рішень щодо управління рідинною терапією. Розглядаються різні типи рідин, включаючи збалансовані розчини та багатофункціональний гіперосмолярний розчин Реосорбілакт, а також підкреслено важливість індивідуалізації терапії в залежності від потреб кожного пацієнта. Підкреслено важливість потреби в ретельному моніторингу та контролі рідинного балансу, щоб уникнути ускладнень і забезпечити покращення клінічних результатів.
Вступ
 Порушення гомеостазу в організмі часто спостерігається під час великих хірургічних втручаннях та критичних станах, таких як сепсис та травми. Важливим аспектом менеджменту під час цих ситуацій є введення відповідних внутрішньовенних розчинів як компонентів рідинної ресусцитації. Внутрішньовенна рідинна терапія відіграє важливу роль у встановленні та підтриманні клітинного гомеостазу у госпіталізованих пацієнтів. Найпоширеніші показання для внутрішньовенного введення великого об’єму рідини у критично хворих пацієнтів включають керування важкою гіповолемією, сепсисом, внутрішньоопераційну корекцію великих втрат крові, гемодинамічні порушення, олігурію або їх комбінацію.
Порушення гомеостазу в організмі часто спостерігається під час великих хірургічних втручаннях та критичних станах, таких як сепсис та травми. Важливим аспектом менеджменту під час цих ситуацій є введення відповідних внутрішньовенних розчинів як компонентів рідинної ресусцитації. Внутрішньовенна рідинна терапія відіграє важливу роль у встановленні та підтриманні клітинного гомеостазу у госпіталізованих пацієнтів. Найпоширеніші показання для внутрішньовенного введення великого об’єму рідини у критично хворих пацієнтів включають керування важкою гіповолемією, сепсисом, внутрішньоопераційну корекцію великих втрат крові, гемодинамічні порушення, олігурію або їх комбінацію.
Незважаючи на роки досліджень, триває широке обговорення щодо найоптимальніших стратегій дозування рідин та належного їх складу для конкретних клінічних умов. Ці дослідницькі питання залишаються актуальними, оскільки наявні дані літератури вказують на те, що стратегії введення рідин можуть значно впливати на клінічні результати, проте, ще й досі немає одностайної думки з цього приводу. Дійсно, використання певних типів та об’ємів рідин може збільшувати ризик негативних наслідків, включаючи навіть смерть, у деяких груп пацієнтів. Адже неналежне використання рідин може бути виявлене майже у 20% пацієнтів, які отримують рідинну терапію.
Дослідження у галузі рідинної терапії постійно вдосконалюється завдяки найновішим досягненням у базових галузях фізіології. Особливо важливим є розуміння структури судинного ендотелію та способу розподілу рідини на капілярному рівні. Відзначається прогрес у фармакокінетичному моделюванні руху екзогенних рідин між рідиною організму. З кожним роком, все більше проводиться клінічних випробувань з метою спростування чи підтвердження попередніх літературних даних, що базуються переважно на невеликих одноцентрових дослідженнях[1, 2].
Ресусцитація рідинами колоїдних та кристалоїдних розчинів є поширеною у медицині невідкладних станів. Вибір та використання реанімаційних рідин ґрунтується на фізіологічних принципах, проте клінічна практика в значній мірі визначається вибором лікаря, проте існує виражена регіональна варіація. Ідеального розчину для рідинної ресусцитації не існує. Нема остаточної думки у великих рандомізованих дослідженнях, а результати невеликих досліджень зазвичай різнонаправленні. Тож логічно, що з’являються нові та грунтовні роботи про тип та дози рідин для ресусцитації, що можуть вплинути на результати лікування пацієнтів.
Незважаючи на те, що можна узяти за основу фізіологічні принципи, колоїдні розчини не забезпечують суттєвих переваг перед кристалоїдними розчинами щодо гемодинамічних ефектів. Альбумін вважається загальновизнаним колоїдним розчином, але його використання обмежується вартістю та рядом недоліків. Хоча визнано, що альбумін є безпечним для використання як реанімаційний розчин у більшості критично хворих пацієнтів і може відігравати роль на початкових стадіях сепсису, його використання пов’язане зі збільшенням смертності серед пацієнтів із черепно-мозковими травмами.
Використання розчинів гідроксиетилкрохмалю пов’язане зі збільшенням частоти проведення замісної ниркової терапії та негативними явищами серед пацієнтів на інтенсивному догляді. Немає доказів на рекомендацію використання інших напівсинтетичних колоїдних розчинів.
Збалансовані кристалоїди є базовими рідинами для початку рідинної ресусцитації, хоча існує мало прямих доказів про їх порівняну безпеку та ефективність. А надмірне використання фізіологічного розчину, як класичного препарату в інфузійній терапії доведено сприяє розвитку метаболічного ацидозу та гострої ниркової недостатності.
Існують дані, що засвідчують позитивний вплив гіпертонічного розчину натрію хлориду на зменшення капілярного витоку та ендотеліальну адгезію нейтрофілів. Гіпертонічний натрію хлорид підвищує артеріальний тиск за рахунок активації гіпоталамо-гіпофізарно-адреналової системи, сприяє збільшенню тонусу судин та затримки рідини в судинному руслі. Однак, при використанні має свої недоліки у вигляді надлишку іонів хлору та натрію, що може призвести до пошкодження нирок з подальшим зниження швидкості клубочкової фільтрації, а також розвитку коагулопатії [32], [33].
Гіперосмолярність може пригнічувати судинний витік без шкоди для вродженої імунної відповіді судинної мікрофізіологічної системи. Крім того, початкова гіперосмолярність призводить до тривалого бар’єрного захисту навіть після ізоосмотичного відновлення. Загалом проактивне лікування пацієнтів із сепсисом гіперосмотичними агентами може спричинити тривалий захист судин і, як наслідок, зупинити руйнівні запальні каскади при важкому сепсисі [34] .
Усі ресустиційні рідини можуть сприяти утворенню міжклітинного набряку, особливо при наявності запалення та при використанні рідин в надмірних кількостях. Лікарі інтенсивної терапії мають розглядати використання ресустиційних рідин так само, як будь-який інший інтравенозний препарат. Вибір конкретного розчину повинен ґрунтуватися на показаннях, протипоказаннях та потенційних токсичних ефектах з метою максимізації ефективності та мінімізації ризиків [3].
Клінічні дослідження часто демонструють, що менше ніж у 50% гемодинамічно нестабільних пацієнтів спостерігається реакція на рідинну терапію. У пацієнтів, наприклад, з захворюваннями серця, надмірне введення рідини може бути шкідливим. Крім того, під час рідинної ресусцитації відбуваються короткочасні явища перерозподілу рідини й гемодинамічної реакції у пацієнтів, з подальшим поверненням об’єму крові до базового рівня через 30-60 хвилин після початкового введення рідини. А у критично хворих пацієнтів з ушкодженням ендотелію та капілярним витоком менше ніж 5% рідинного пулу залишається інтраваскулярно після 90 хвилини [4, 5, 6, 7].
Великий об’єм ресусцитації рідинами призводить до важкого набряку тканин та клінічних ознак передозування рідиною. Набряк тканин ускладнює дифузію кисню та метаболітів, спотворює архітектуру тканин, перешкоджає кровообігу в капілярах та лімфатичному дренажу та порушує взаємодію клітин. Ці ефекти особливо виражені в капсульованих органах, таких як печінка та нирки, які не мають здатності вміщувати додатковий об’єм без збільшення міжклітинного тиску, що призводить до порушення кровообігу в органі та його ішемії.
Крім того, великий об’єм рідини збільшує внутрішньочеревний тиск, що в подальшому ущільнює нирковий та печінковий кровотік. Таким чином, капілярний витік значно сприяє розвитку внутрішньочеревної гіпертензії. Багато досліджень показали, що позитивний баланс рідини асоціюється з порушенням функції органів та збільшеним ризиком смертності. Проте досі залишається значною мірою недовединим, чи асоціюється із покращенням лікування стратегії, що спрямовані на нейтральний або навіть негативний рідинний баланс після початкової фази ресусцитації. Завдяки позитивним результатам в роботах останніх років, ціль-орієнтована терапія стала поширеною стратегією, метою якої є швидка корекція шоку та гіпоперфузії протягом декількох годин.
Щодо настанов широковідомої компанії “Виживання під час сепсису”, що головним чином фокусована на початковій ресусцитації великими об’ємами, має суттєве обмеження, у зв’язку з тим, що відсутня інформація щодо оцінки перевантаження об’ємом (що не є рекомендованим у великій кількості клінічних ситуацій), а тим більше не має настанов коли та як проводити розвантаження. В цьому ракурсі слід зауважити, що центральний венозний тиск відображає мало корисної інформації щодо загального досягнення необхідного об’єму проведеної інфузії пацієнта та необхідності розвантаження [8, 9, 10, 11].
У періопераційному періоді певний ступінь гіперволемії необхідний для підтримки перфузії органів. Однак, рідина, яку вводять після введення анестезії, в основному збільшує “нерозгалужений” об’єм крові, що пов`язано із вазодилатацією, що виникає внаслідок анестезії. На цей момент потрібне додаткове введення рідини для оптимізації серцевого викиду тобто додаткова інфузія до “розгалуженого” інтраваскулярного об’єму.
Багато лікарів все ще розглядають цей “вологий” підхід як золотий стандарт для внутрішньоопераційної рідинної терапії, хоча розширення інтраваскулярного об’єму, безперечно, несе певні застороги. Робота міокарда й кардіальний тиск зростають, коли об`єм рідини перевищує ступінь вазодилатації спричиненої анестезією. Більше того, перевантаження рідиною знижує колоїдно-осмотичний тиск, що, спільно з підвищеним кардіальним тиском, може сприяти пульмональному набряку. Ці питання мають особливе значення для пацієнтів із несприятливим кардіоваскулярним статусом [12, 13, 14].
Введення рідини є одним з основних аспектів інтенсивної терапії у критично хворих пацієнтів. Питання, скільки рідини слід вводити, є предметом жвавих дискусій протягом багатьох років. Надмірне введення рідини може мати шкідливі наслідки для різних органів і систем, наприклад, погіршувати газообмін, функцію нирок та загоєння ран. Перевантаження рідиною особливо імовірно виникає в умовах зміненої проникності капілярів через запальну реакцію, таку як при сепсисі. Позитивний баланс рідини асоціювався з гіршими результатами в кількох дослідженнях різних груп пацієнтів у відділенні інтенсивної терапії (ВІТ).
У пацієнтів із септичним шоком, введення рідини та позитивний баланс рідини були незалежно пов’язані з підвищеними показниками смертності. Аналогічно, у пацієнтів, які були госпіталізовані у ВІТ після великих хірургічних втручань, баланс рідини виявився незалежним фактором ризику смерті. Дійсно, обмежувальна стратегія введення рідини, що спрямована на досягнення негативного балансу рідини у пацієнтів із гострим ушкодженням легень асоціювалася з покращенням результатів у ретроспективних дослідженнях [15, 16, 17, 18, 19].
Недостатня ресусцитація через недостатнє введення рідини, навпаки може призвести до гіршої перфузії тканин та, отже, до дисфункції органів і їх недостатності, особливо на ранніх стадіях лікування. Необхідно досягти балансу, щоб кожен пацієнт отримував достатньо, але не надмірно, тобто відповідно до його потреб. Вкрай важливо, що різні пацієнти матимуть різні потреби та базовий статус рідини в залежності від багатьох факторів, таких як вік, супутні захворювання та наявний діагноз. Крім того, необхідно враховувати показники толерантності до рідини, такі як центральний венозний тиск (ЦВТ), оксигенація та рівні гемоглобіну. Потреба в рідині змінюється протягом хвороби.
Таким чином, рідини повинні призначатися із розрахунком на кожного пацієнта індивідуально; призначення слід регулярно переглядати та коригувати відповідно до змінного клінічного стану. Відповідь на питання, чи є перевантаження рідиною проблемою в ВІТ, залежатиме від моменту, в який його поставлено. У фазі гострої реанімації/ресусцитації введення рідини повинно бути масивним. Хоча перевантаження рідиною завжди має бути предметом занепокоєння, позитивний баланс рідини є специфічною метою цієї фази [14].
Враховуючи відсутність збалансованої стратегії у вирішенні цих питань та відсутності адекватних чи більш-менш однозначних відповідей, що стосується рідинної ресусцитації хворих у критичних станах, в останні роки на основі робіт Hoste E.A. та спів.авт. [2], Malbrain M. та співавт. [8] та Vincent J.L. [20] було сформовано концепцію рідинної ресусцитації ROSE з відповідними фазами: R – ресусцитація, O – оптимізація, S – стабілізація, та E – евакуація (рис.1.).
РИС. 1. Фази рідинної ресусцитації протягом шоку. Адаптовано Malbrain M. та спів.авт. [8, 14].
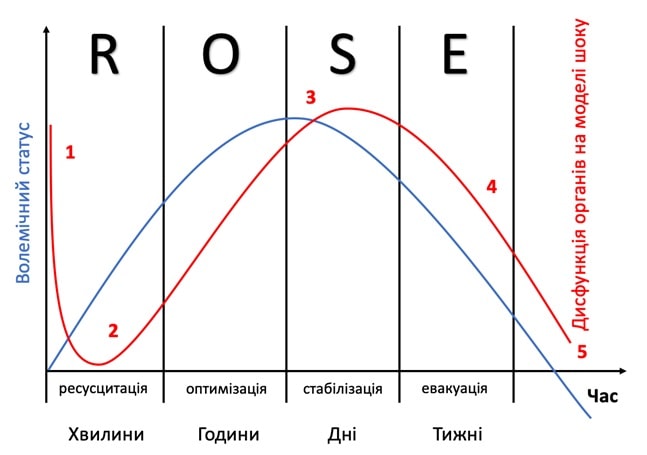 Графік синього кольору, що показує динаміку кумулятивного об’єму рідини у пацієнтів протягом п’яти різних фаз рідинної реанімації шокового стану: ресусцитація (R), оптимізація (O), стабілізація (S) та евакуація (E) (ROSE), за якими слідує можливий ризик гіпоперфузії (5) у випадку надмірної декомпенсації.
Графік синього кольору, що показує динаміку кумулятивного об’єму рідини у пацієнтів протягом п’яти різних фаз рідинної реанімації шокового стану: ресусцитація (R), оптимізація (O), стабілізація (S) та евакуація (E) (ROSE), за якими слідує можливий ризик гіпоперфузії (5) у випадку надмірної декомпенсації.
Червоний графік, що ілюструє «чотиристадійну модель шоку» відповідно до впливу на функцію органів залежно від рівня рідини в організмі. При надходженні пацієнтів спостерігається гіповолемія (1), за якою слідує нормоволемія (2) після рідинної ресусцитації та перевантаження рідиною (3), знову ж таки за нею слідують фази нормоволемії (4) та гіповолемії з ризиком гіпоперфузії (5). У випадку гіповолемії (фази 1 і 5) кисень не може потрапити в тканини через проблеми з його доставкою, у випадку гіперволемії (фаза 3) кисень не може потрапити в тканини через проблеми дифузії, що пов’язано з міжклітинним та легеневим набряком, набряком кишечника (ілеус та абдомінальна гіпертензія).
Фаза ресусцитації (R) У першій фазі рятування/реанімації, коли пацієнт перебуває в стані гемодинамічного шоку, а метою лікування є ресусцитація та корекція шоку з досягненням адекватного перфузійного тиску. Ця фаза тяжкого шоку, яка може загрожувати життю, виникає протягом кількох хвилин і характеризується низьким середнім артеріальним тиском, низьким серцевим викидом та порушеннями мікроциркуляції.
Можуть бути проблеми з доставкою кисню до тканин, в умовах важкої гіповолемії. Потрібно швидко ввести болюс рідини (хоча точна кількість може варіюватися, зазвичай 3–4 мл/кг вводять протягом 10–15 хвилин і повторюють, якщо потрібно), зазвичай та інколи навіть бажано у супроводі введення вазопресорів. Паралельно необхідно виконати невідкладні процедури для усунення будь-якої очевидної основної причини, а також розпочати гемодинамічний моніторинг. У цій фазі мета полягає в ранньому адекватному цілеспрямованому управлінні рідиною: баланс рідини має бути позитивним.
Більшість авторів не підтримують сліпе дотримання рекомендацій кампанії “Виживання від сепсису” з дотриманням правил введення 30 мл/кг рідини протягом першої години для всіх пацієнтів, як було зазначено раніше. Це може призвести до перевантаження або недостатньої рідинної ресусцитації деяких пацієнтів. Кожен пацієнт потребує індивідуального та персоналізованого підходу. Метою є раннє адекватне цілеспрямованне управління рідиною (EAFM). Баланс рідини має бути позитивним, а цілі рідинної ресусцитації такі: середній артеріальний тиск (MAP) > 65 мм рт. ст., серцевий індекс (CI) > 2,5 л/хв/м², позитивний цикл тиску (PPV) < 12%, індекс кінцево-діастолічного об’єму лівого шлуночка (LVEDAI) > 8 см/м².
Фаза оптимізації (О) Фаза оптимізації розпочинається, коли пацієнт більше не перебуває в явній абсолютній чи відносній гіповолемії, але залишається гемодинамічно нестабільним. Під час цієї фази ситуація залишається нестабільною, але пацієнт більше не перебуває в безпосередній небезпеці для життя; скоріш всього, він перебуває на стадії компенсованого шоку (все ще з високим ризиком декомпенсації). Будь-яка додаткова рідинна терапія повинна вводитися обережніше та титруватися з метою протекції серцевої функції для покращення перфузії тканин із кінцевою метою уникнення дисфункції або недостатності органів.
На цьому етапі вже будуть впроваджені якісь форми моніторингу. Рідини повинні вводитися відповідно до індивідуальних потреб пацієнта і регулярно переоцінюватися. Оптимізація рідини повинна проводитися обережно, враховуючи чотири основні компоненти (TROL): тип рідини (наприклад, збалансований кристалоїд; швидкість (100–200 мл за 10 хвилин); мета (наприклад, нормальний артеріальний тиск або частота серцевих скорочень); і обмеження (наприклад, високий рівень центрального венозного тиску). Метою цієї фази є оптимізація та підтримка адекватної перфузії тканин і оксигенації для запобігання та обмеження ушкодження органів.
Потрібно уважно проводити моніторинг пацієнта під час фази оптимізації: часто потрібні кілька типів моніторингу (наприклад, артеріальний катетер, ехокардіографія, центральний венозний тиск, артеріовенозні гази крові) для отримання найбільш повної картини гемодинамічного статусу пацієнта.
Хоча ресусцитація з орієнтацією на мікроциркуляторні кінцеві точки має на меті покращити мікроциркуляцію, аналогічно, може бути відсутня узгодженість між макро- та мікроциркуляцією. Таким чином, маркери гіпоперфузії повинні включати також лактат, подовжений час заповнення капілярів, для визначення ступеня порушень мікроциркуляції. [21, 22].
Отже, метою є підтримка перфузії тканин, а рідини слід розглядати не лише як додаткову терапію, але й як таку, що може врятувати органи. Баланс рідини повинен змінитися з позитивного на нейтральний, а цілі ресусцитації є: середній артеріальний тиск (MAP) > 65 мм рт. ст., серцевий індекс (CI) > 2,5 л/хв/м², позитивний тисковий цикл (PPV) < 14%, індекс кінцево-діастолічного об’єму лівого шлуночка (LVEDAI) 8−12 см/м². У цій фазі контролюються внутрішньочеревний тиск (IAP < 15 мм рт. ст.) та артеріальний перфузійний тиск (APP > 55 мм рт. ст.).
Фаза стабілізації (S). Якщо пацієнт став стабільним, розпочинається фаза стабілізації, яка триває кілька днів. У цій фазі метою управління рідиною є забезпечення води та електролітів для заміщення поточних втрат і надання підтримки органам. Ця фаза гомеостазу зосереджується на підтримці органів і відображає момент, коли пацієнт перебуває в стабільному стані, тому рідинна терапія тепер використовується лише для поточних потреб заміщення рідин, що втрачаються, або в умовах нормальних втрат рідин (тобто ниркових, шлунково-кишкових, поточних), але також можуть бути введені рідини (включаючи повторну гідратацію), якщо пацієнт зазнає постійних втрат через неусунені патологічні стани.
Однак ця стадія відрізняється від попередніх двох відсутністю шоку (компенсованого чи дещо незбалансованого) або близькою загрозою шоку. Ідеально, щодобово слід вимірювати вагу тіла, а кумулятивний баланс рідини потрібно розраховувати для оцінки ризику перевантаження рідиною. Аналіз біоелектричного імпедансного аналізу (BIA) з розрахунком екстра- та внутрішньоклітинної води (ECW, ICW), загальної води в тілі (TBW) та надмірного об’єму (VE) може надати додаткову інформацію. Метою має бути нульовий або трохи негативний баланс рідини.
Фаза евакуації (Е). Після другої стадії сепсису (див. рис.1) можуть статися дві речі: або пацієнт продовжує відновлюватися і спонтанно переходить у фазу виведення надлишку рідини, яка не була введена раніше. Проте багато пацієнтів в відділенні інтенсивної терапії залишаються в стані «без виведення рідини», за яким слідує третя стадія шоку, зазвичай спричинена системним синдромом підвищеної проникності (GIPS), з подальшим накопиченням рідини через капілярний витік. Додаткове введення рідини на цьому етапі стає шкідливим для пацієнта.
Периферичний набряк та анасарка — це не тільки косметична проблема, як вважають деякі, але й небезпечні для пацієнта патологічні процеси, оскільки призводять до дисфункції органів та можуть самі по собі бути причиною поліорганної недостатності.
Під час перших трьох стадій («ROS») рідини зазвичай вводяться (спочатку як рятувальні, потім для підтримки, і нарешті як заміна основного рідинного компоненту), у останній стадії, фазі евакуації (що відповідає «Е» в концепції ROSE), рідину потрібно активно виводити з пацієнта протягом днів або тижнів, щоб підтримати відновлення органів. Мета на цьому етапі — сприяти негативному балансу рідини через мобілізацію накопичених рідин за допомогою стратегії пізнього цілеспрямованого видалення рідини (LGFR), також відомої як дересусцитація.
Пізнє цілеспрямоване видалення рідин включає агресивне та активне видалення рідин за допомогою діуретиків та навіть проведення замісної ниркової терапії з ультрафільтрацією, переходом до негативного водного балансу. Моніторинг під час цієї фази має зосередитися на оцінці перевантаження рідиною та його впливу на функцію органів. Недавні дослідження показали, що два поспіль дні негативного водного балансу протягом першого тижня перебування у відділенні інтенсивної терапії є сильним і незалежним предиктором виживання [8, 14, 23, 24].
Очевидно, що ризик на цій фазі полягає в тому, щоб не занадто агресивно виводити рідину з організму та не викликати значну гіповолемію, яка може спричинити “четвертий шоковий удар”, що призведе гемодинамічного погіршення та гіпоперфузії (рис. 1). [8, 14, 25].
Під час проведення рідинної ресусцитації завжди постає питання про доречність різних розчинів на різних фазах під час виконання вищезазначеної концепції. Так у фазах ресусцитації та оптимізації автори схиляються до застосування збалансованих кристолоїдів, однак й теоретично вказують на переваги перед кристалоїдами колоїдів через більшу здатність до розширення об’єму плазми й довший період напіврозпаду в плазмі.
Водночас, вони мають недолік у вигляді затримки часу згортання крові та підвищення ризику ушкодження нирок. У цьому контексті можуть бути цікавими спостереження, що у основних дослідженнях, які вказують на шкідливий вплив крохмалю, цей колоїд вводився у великій кількості саме у фазі стабілізації, тобто в фазі, яка, можливо, не вимагала застосування цих препаратів, а це може вказувати на не коректні висновки вищезазначених досліджень. Найчастіше виправдане застосування різних типів рідин.
Наприклад, численні комбінації розчинів можуть використовуватися у щоденній практиці для ресусцитації: кров та кристалоїди (травма), кристалоїди на ранніх етапах (післяопераційна гіповолемія), альбумін на пізніх етапах (сепсис). Аналогічно, підтримуючі рідини часто є комбінацією ентерального та парентерального харчування, інших розчинів, які містять глюкозу, фізіологічного розчину та/або збалансованих кристалоїдів для розчинення медикаментів [14, 25, 26, 27].
В цьому контексті певне місце, особливо на фазах оптимізації (О) та стабілізації (S) згідно концепції ROSE потенційно може зайняти вітчизняний розчин Реосорбілакт (ТОВ «Юрія-фарм»), враховуючи, що останніми роками проведено декілька міжнародних багатоцентрових клінічних досліджень, щодо його ефективності та безпеки застосування у комплексній терапії опікової хвороби (RheoSTAT-CP0669), сепсису (RheoSTAT-CP0620) та пневмонії (RheoSTAT-CP0698) [28, 29, 30].
Так, в результаті дослідження цього препарату при лікуванні тяжкої опікової хвороби доведено, що Реосорбілакт введений у дозі 7 мл/кг для відновлення гіповолемії, чинить гемодинамічну дію. Дослідженням помпової функції серця у разі застосування реосорбілакту в динаміці встановлено, що на 2–гу добу фракція викиду збільшується на 4% відносно 1–ї доби і на 2% відносно хворих порівняльної групи, що дає підґрунтя для застосування його на етапі оптимізації (О) [28, 31].
Щодо застосування препарату на етапі стабілізації (S), то під час дослідження терапії опікової хвороби доведено, що малооб’ємна ІТ Реосорбілактом у дозі 200-400 мл/добу дає змогу зменшити загальний об’єм інфузії, потрібної для досягнення терапевтичного ефекту, без ризику гіпергідратації та перевантаження рідиною. Під час даної терапії у пацієнтів з пневмонією представлено дані про збільшення об’єму циркулюючої крові, на що вказують істотне підвищення ЦВТ і стабілізація показників артеріального тиску й частоти серцевих скорочень.
З іншого боку, після 3-денного курсу інфузій показники ЦВТ не підвищилися до критично високих рівнів, що дало змогу зменшити загальний об’єм інфузії, необхідної для досягнення терапевтичного ефекту без ризику гіпергідратації та перевантаження рідиною, що особливо важливо в пацієнтів старшого віку з коморбідністю чи при критичних станах, які мають особливо несприятливий прогноз у разі пневмонії. При дослідженні малооб’ємної інфузії при сепсисі автори дійшли до подібних висновків про збільшення об’єму циркулюючої крові на тлі зменшення загального об’єму інфузії, необхідної для досягнення терапевтичного ефекту, таким чином усуваючи ризик надмірної гідратації та перевантаження рідиною [29, 30].
Отже, не дивлячись на беззаперечну важливість рідинної терапії в умовах порушень гомеостазу організму під час великих хірургічних втручань та критичних станів, де використання внутрішньовенних розчинів є одним із найбільш поширених підходів, ідеального розчину не існує. У світлі останніх досліджень необхідний перегляд того, як внутрішньовенні рідини повинні використовуватися в періопераційному періоді та при інтенсивній терапії критичних станів. Але концепція рідинної ресусцитації ROSE, яка включає етапи ресусцитації, оптимізації, стабілізації та евакуації, може допомогти у покращенні підходів до управління рідинною терапією в клінічній практиці лікаря анестезіолога та в медицині критичних станів.
Автори:
- Дзюба Дмитро Олександрович1,2
- Недашківський Сергій Михайлович1
1 КНП КОР “Київська обласна клінічна лікарня”, м. Київ, Україна.
2 Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна.
Висновки:
- Під час великих хірургічних втручань або критичних станів (сепсис, травми) часто виникають порушення гомеостазу рідин для стабілізації якого необхідна адекватна рідинна ресусцитація.
- Неправильне або надмірне введення рідин може призвести до серйозних наслідків, включно з підвищеною смертністю. Одним зі шляхів вирішення цієї проблеми є індивідуалізація терапії, що базується на розумінні патофізіології порушень, що виникають на кожному етапі критичних станів. Одним з варіантів вирішення цієї проблеми є впровадження у щоденну практику концепції рідинної ресусцитації ROSE, яка складається з чотирьох етапів: ресусцитація (R), оптимізація (O), стабілізація (S), евакуація (E). Це дозволяє покращити управління рідинною терапією/ ресусцитацією.
- В контексті рідинної терапії у критичних станах є перспективним застосування розчину Реосорбілакт, зважаючи на потенціал згідно досліджень останніх років, особливо на фазах оптимізації (О) та стабілізації (S), відповідно до концепції ROSE
Література:
- Edwards, M. R., & Mythen, M. G. (2014). Fluid therapy in critical illness. Extreme Physiology & Medicine, 3, 1-9.
- Hoste, E. A. et al. (2014). Four phases of intravenous fluid therapy: a conceptual model. British Journal of Anaesthesia, 113(5), 740-747.
- Myburgh, J. A., & Mythen, M. G. (2013). Resuscitation Fluids. New England Journal of Medicine, 369, 1243–1251.
- Dellinger, R. P., Levy, M. M., Rhodes, A. et al. (2013). Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Critical Care Medicine, 41, 580−637.
- Marik, P. E., Monnet, X., & Teboul, J. L. (2011). Haemodynamic parameters to guide fluid therapy. Annals of Intensive Care, 1, 1.
- Chowdhury, A. H., Cox, E. F., Francis, S. T., & Lobo, D. N. (2012). A randomised, controlled, double-blind crossover study on the effects of 2-L infusions of 0.9% saline and Plasmalyte® 148 on renal blood flow velocity and renal cortical tissue perfusion in healthy volunteers. Annals of Surgery, 256, 18−24.
- Sanchez, M., Jimenez-Lendinez, M., Cidoncha, M. et al. (2011). Comparison of fluid management in non-septic patients. Anaesthesia and Intensive Care, 39, 1022−1029.
- Malbrain, M. et al. (2014). Fluid overload, de-resuscitation, and outcomes in critically ill or injured patients: a systematic review with suggestions for clinical practice. Anestezjologia Intensywna Terapia, 46(5), 377-396.
- Marik, P. E. (2014). Iatrogenic salt water drowning and the hazards of a high central venous pressure. Annals of Intensive Care, 4, 21.
- Malbrain, M., & Van Regenmortel, N. (2012). Fluid overload is not only of cosmetic concern (Part I): Exploring a new hypothesis. ICU Management, 12, 30−33.
- Messmer, A. S. et al. (2023). Active fluid de-resuscitation in critically ill patients with septic shock: A systematic review and meta-analysis. European Journal of Internal Medicine, 109, 89-96.
- Magder, S. (2016). Volume and its relationship to cardiac output and venous return. Critical Care, 20, 271.
- Miller, T. E., Roche, A. M., & Mythen, M. (2015). Fluid management and goal-directed therapy as an adjunct to Enhanced Recovery After Surgery (ERAS). Canadian Journal of Anaesthesia, 62(2), 158–168.
- Malbrain, M. L. N. G. et al. (2020). Intravenous fluid therapy in the perioperative and critical care setting: executive summary of the International Fluid Academy (IFA). Annals of Intensive Care, 10, 1-19.
- Acheampong, A., & Vincent, J. L. (2015). A positive fluid balance is an independent prognostic factor in patients with sepsis. Critical Care, 19, 251.
- De Oliveira, F. S. et al. (2015). Positive fluid balance as a prognostic factor for mortality and acute kidney injury in severe sepsis and septic shock. Journal of Critical Care, 30(1), 97–101.
- Silva, J. M. Jr et al. (2013). The effect of excess fluid balance on the mortality rate of surgical patients: a multicenter prospective study. Critical Care, 17(6), R288.
- Marik, P. E. et al. (2017). Fluid administration in severe sepsis and septic shock: patterns and outcomes: an analysis of a large national database. Intensive Care Medicine, 43(5), 625–632.
- Cordemans, C. et al. (2012). Aiming for a negative fluid balance in patients with acute lung injury and increased intra-abdominal pressure: a pilot study looking at the effects of PAL-treatment. Annals of Intensive Care, 2(Suppl 1), S15.
- Vincent, J. L., & De Backer, D. (2013). Circulatory shock. New England Journal of Medicine, 369, 1726-3417.
- Vincent, J. L. (2011). Let’s give some fluid and see what happens” versus the “mini-fluid challenge. Anesthesiology, 115(3), 455–456.
- Bennett, V. A., Vidouris, A., & Cecconi, M. (2018). Effects of fluids on the macro- and microcirculations. Critical Care, 22(1), 74.
- Malbrain, M. L. N. G. et al. (2024). Rational Use of Intravenous Fluids in Critically Ill Patients. Springer Nature, 598.
- Cordemans, C. et al. (2012). Fluid management in critically ill patients: the role of extravascular lung water, abdominal hypertension, capillary leak, and fluid balance. Annals of Intensive Care, 2(Suppl 1), S1.
- Malbrain, M. L. N. G. et al. (2018). Principles of fluid management and stewardship in septic shock: it is time to consider the four D’s and the four phases of fluid therapy. Annals of Intensive Care, 8, 1-16.
- Annane, D. et al. (2013). Effects of fluid resuscitation with colloids vs crystalloids on mortality in critically ill patients presenting with hypovolemic shock: the CRISTAL randomized trial. JAMA, 310(17), 1809–1817.
- Myburgh, J. A. et al. (2012). Hydroxyethyl starch or saline for fluid resuscitation in intensive care. New England Journal of Medicine, 367(20), 1901–1911.
- Нагайчук, В. І. et al. (2023). Перші результати міжнародного багатоцентрового клінічного дослідження RheoSTAT-CP0669 щодо ефективності та безпеки інфузійного розчину Реосорбілакт® у комплексному лікуванні пацієнтів з опіковою хворобою. INFUSION & CHEMOTHERAPY, 4, 5-12.
- Шаріпова, В. Х. et al. (2022). Перші результати міжнародного багатоцентрового клінічного дослідження RheoSTAT-CP0620 щодо ефективності та безпеки інфузійного розчину Реосорбілакт® у комплексній терапії сепсису. INFUSION & CHEMOTHERAPY, 2, 11-20.
- Фещенко, Ю. І. et al. (2021). Перші дані міжнародного багатоцентрового клінічного дослідження RheoSTAT-CP0698 щодо ефективності та безпеки інфузійного розчину Реосорбілакт® у комплексній терапії пневмонії. Пульмонологія, 5(498), 18-21.
- Kovalenko, O. M. (2019). Лікування опікового шоку на спеціалізованому етапі. The Ukrainian Journal of Clinical Surgery, 86(8), 55-58.
- Hypertonic saline resuscitation of hemorrhagic shock diminishes neutrophil rolling and adherence to endothelium and reduces in vivo vascular leakage
- urgent.com.ua/ua/archive/2018/1%2870%29/pages-5-13/oglyad-ievropeyskoyi-nastanovi-z-likuvannya-masivnih-krovotech-ta-koagulopatiy-pislya-travmi
- nlm.nih.gov/pmc/articles/PMC10161024/