Сучасний підхід до седації під час реґіонарної анестезії в гінекології
Резюме. У даний час однією з актуальних проблем в анестезіології є безпечна й адекватна седація при регіонарній анестезії. Згідно з основними принципами сучасної анестезіології, безпечна і ефективна седація повинна забезпечити захист психоемоційної сфери пацієнта, відсутність пробудження, відсутність відчуття болю і страху, відсутність нудоти і блювоти в післяопераційному періоді; у той же час не повинна викликати депресії дихання і впливу на гемодинаміку, а так само не повинна супроводжуватися уповільненим відновленням психомоторної функції.
Після вивчення сучасної літератури і аналізу власних спостережень ми дійшли висновку, що в умовах регіонарної анестезії кращою є седація дексмедетомідином, а не пропофолом. Седація Дексмедетомідином веде до зменшення частоти когнітивних порушень у ранньому післяопераційному періоді, зниження інтенсивності больового синдрому, сприятливого впливу на відновлення й активацію після операції, а також асоціюється з меншою частотою розвитку гіпоксемії та гіпотензії під час операції.
Ключові слова: седація, регіонарна анестезія, дексмедетомідин.
Вступ
Із сучасних позицій оптимізація анестезіологічної допомоги розглядається не тільки як підвищення рівня безпеки хворого, але й у контексті якості періопераційного періоду. Одним з таких критеріїв адекватної анестезії є якнайшвидша фізична і психосоціальна реабілітація пацієнта після оперативного лікування.
Незважаючи на те, що застосування малотравматичних хірургічних методик та різних методів реґіонарної анестезії сприяє значному прогресу в зниженні післяопераційних ускладнень, зменшення термінів перебування хворого в стаціонарі, проблема швидкого відновлення вищих психічних функцій залишається актуальною.
В даний час післяопераційна когнітивна дисфункція є одним із факторів, який перешкоджає скороченню перебування хірургічного хворого в стаціонарі. Емоційне напруження, відносна соціальна ізоляція, пов’язана з перебуванням пацієнта в хірургічних відділеннях, необхідність застосування препаратів із психотропним ефектом, літній і старечий вік є незалежними і взаємопосилюючими факторами розвитку післяопераційних когнітивних порушень.
Проблема післяопераційного психомоторного збудження часто призводить до необхідності інтенсивного спостереження, а спроби форсувати медикаментозну седацію з метою корекції поведінки можуть бути причиною різних ускладнень і несприятливих наслідків лікування.
Згідно з основними принципами сучасної анестезіології, безпечна й ефективна седація повинна забезпечити насамперед захист психоемоційної сфери хворого. Мається на увазі, поряд з підтриманням життєво важливих функцій організму на тлі реґіонарної анестезії, відсутність пробудження, відсутність відчуття болю і страху, відсутність нудоти і блювоти в післяопераційному періоді [1].
В той же час надмірна седація при реґіонарній анестезії поряд з депресією дихання і гемодинаміки супроводжується уповільненим відновленням психомоторної функції.
Завдання процедурної седації:
• мінімізувати занепокоєння, біль і дискомфорт;
• забезпечити часткову (або повну) амнезію;
• забезпечити іммобілізацію для виконання точної процедури;
• уникнути інтубації трахеї та можливих ускладнень загальної анестезії;
• мінімізувати гемодинамічні реакції;
• раннє пробудження і відновлення.
Частими препаратами для інтраопераційної седації в гінекології є:
• пропофол;
• тіопентал натрію;
• сибазон або мідазолам;
• кетамін.
Такі способи інтраопераційної седації виправдані з точки зору “неприсутності” хворого на своїй операції, але можуть призвести до негативних наслідків у післяопераційному періоді. Доведено, що бензодіазепіни провокують появу делірію; барбітурати призводять до тривалих мнестичних порушень (порушення пам’яті та орієнтації в просторі), а пропофол, по суті, є препаратом для наркозу і не відповідає вимогам, які стоять перед препаратами для керованої седації. До негативних наслідків, які можуть виникнути в інтраопераційному періоді, необхідно віднести нестабільність гемодинаміки і порушення адекватного самостійного дихання.
На сьогодні найкращим препаратом для процедурної седації у неінтубованних дорослих пацієнтів є дексмедетомідин [2]. Його використання з цією метою детально вивчалося в проспективних рандомізованих дослідженнях, описаних у медичній літературі. Базовими дослідженнями застосування дексмедетомідину в процедурній седації у дорослих пацієнтів є дослідження MAC і AWAKE [3, 4]. У цих дослідженнях ідеться про те, що дексмедетомідин є селективним агоністом 2-адренорецепторів, розробленим з метою забезпечення легкої та помірної седації дорослих пацієнтів.
Дексмедетомідин має унікальну здатність забезпечувати седацію “у співпраці з пацієнтом”. Пацієнти, які отримують дексмедетомідин, спокійні, проте при необхідності легко пробуджуються і готові співпрацювати з медичним персоналом. Як вказують у своїх роботах W. Wu і співавт., дексмедетомідин може розглядатись в якості більш адекватного альтернативного варіанта [5]. Відмітною особливістю препарату є його керованість.
У дослідженні Т. Ebert і співавт. [6] оцінювався седативний ефект дексмедетомідину при послідовно зростаючих значеннях швидкості інфузії. У даній роботі було продемонстровано залежність седативного ефекту від дози препарату. При цьому у пацієнтів спостерігалося збереження здатності до пробудження, а також висока кореляція між глибиною седації і показниками біспектральної електроенцефалографії [6].
В Україні в кінці 2018 року було зареєстровано дексмедетомідин від вітчизняного виробника “ЮріяФарм”.
У даний час однією з актуальних проблем в анестезіології є безпечна та адекватна седація під час реґіонарної анестезії.
Матеріали та методи
Обстежено 64 жінки із захворюваннями жіночих статевих органів, яким у плановому порядку виконувалися операції в умовах реґіонарної анестезії (спінальної та комбінованої спінально-епідуральної анестезії) з приводу аденоміозу, міоми матки, випадіння матки.
Дослідження проводили в процесі проведення седації на тлі реґіонарної анестезії. Середній вік хворих склав 48 (43–52) років, маса тіла 78 (71–89) кг, зріст 165 (162–168) см. Фізичний стан пацієнток за класифікацією Американської асоціації анестезіологів (ASA) відповідав I–II функціональному класу. У дослідження не увійшли жінки, які мали важкі серцево-легеневі, ендокринні, неврологічні захворювання, ожиріння III ст. Ознак дегідратації у пацієнток не було. Як місцевий анестетик використовували ЛОНГОКАЇН® ХЕВІ. Відповідно до методу седації пацієнток було поділено на дві групи:
• 1 група – 25 пацієнток, використовували дексмедетомідин з метою інтраопераційної седації;
• 2 група – 39 жінок, використовували пропофол з метою інтраопераційної седації.
Усі хворі перед майбутнім втручанням були обстежені стандартно. Безпосередньо перед оперативним втручанням встановлювали катетер в одну з периферичних вен верхніх кінцівок (як правило, зліва) і починали інфузію збалансованого кристалоїдного розчину. Моніторинг – стандартний, що передбачав постійну реєстрацію і аналіз ЕКГ, пульсоксиметрію, реєстрацію частоти дихання, вимір через кожні 5 хв артеріального тиску. Рівень седації оцінювали за шкалою Рамсея (RSS). Цільові значення були спрямовані на досягнення седації в 4–5 балів. Шкала Рамсея від 1 до 6 градацій, базується на простих клінічних умовах. Чим більше балів за шкалою, тим вищий ступінь глибини седації:
• пацієнт збуджений або неспокійний;
• пацієнт не спить, орієнтований, спокійний, співпрацює з персоналом;
• пацієнт не спить, але реагує тільки на команди;
• пацієнт спить, жваво реагує на тактильний стимул або гучний окрик;
• пацієнт спить, мляво реагує на тактильний стимул або гучний окрик;
• пацієнт спить, не реагує на тактильний стимул або гучний окрик.
Інфузійну підтримку здійснювали збалансованими кристалоїдними розчинами 10–15 мл/кг/год. Для корекції артеріальної гіпотензії (визначалась нами як зниження систолічного артеріального тиску понад 25 % від початкового рівня або нижче 90 мм рт.ст.) ми збільшували темп інфузії кристалоїдів, а у випадках рефрактерності до проведених заходів внутрішньовенно вводили розчин мезатону (фенілефрину).
Усі пацієнтки перебували на спонтанному диханні з подачею кисню через носовий катетер зі швидкістю 3–4 л/хв. Тривалість операції не перевищувала 2 години.
У першій групі (дексмедетомідин, Юрія-Фарм) технологія інтраопераційної седації складалась із навантажувальної дози дексмедетомідину 1 мкг/кг, яку вводили протягом 10 хв, та підтримуючої дози 0,5– 0,7 мкг/кг/год. Введення дексмедетомідину припиняли за 5 хв до закінчення операції.
У другій групі (пропофол) технологія інтраопераційної седації складалась із внутрішньовенного болюсного введення пропофолу від 0,5 до 1 мг/кг протягом 1 хвилини. Підтримання седативного ефекту забезпечували шляхом титрування інфузії 1 % пропофолу до необхідного рівня вираженості седативного ефекту. Для більшості пацієнток необхідно було від 1 до 4 мг/кг/год. Крім інфузії, проводили болюсне введення від 10 до 20 мг, якщо рівень седативного ефекту був недостатнім.
У процесі проведення седації на тлі спінальної анестезії ми порівнювали між двома групами:
- Розвиток гіпотензії під час операції.
- Розлади дихання (гіпоксемія) при досягненні цільового значення седації в 4–5 балів за шкалою Рамсея.
- Вплив седації на когнітивні функції.
- Вплив на рівень знеболення в післяопераційному періоді.
Результати й обговорення
Поширеною є думка про вплив анестезії на когнітивні функції після операції, що знайшло підтвердження і в нашому дослідженні [7]. Аналіз результатів дослідження показав більш сприятливий вплив інтраопераційної седації дексмедетомідином порівняно з пропофолом при спінальній анестезії на перебіг післяопераційного періоду у жінок середнього віку після планових гінекологічних операцій.
Дексмедетомідин (Юрія-Фарм) показав себе як ефективний і безпечніший препарат для седації при проведенні спінальної анестезії, ніж пропофол. Висока якість седації, безпека і раніше відновлення свідомості дозволяють використовувати дексмедетомідин як седативний препарат при спінальній анестезії. Седація дексмедетомідином при проведенні спінальної анестезії, ніж пропофол. Висока якість седації, безпека і раніше відновлення свідомості дозволяють використовувати дексмедетомідин як седативний препарат при спінальній анестезії. Седація дексмедетомідином при проведенні спінальної анестезії викликає розвиток гіпотензії на 26,5 % рідше, ніж седація на основі пропофолу (рис. 1).
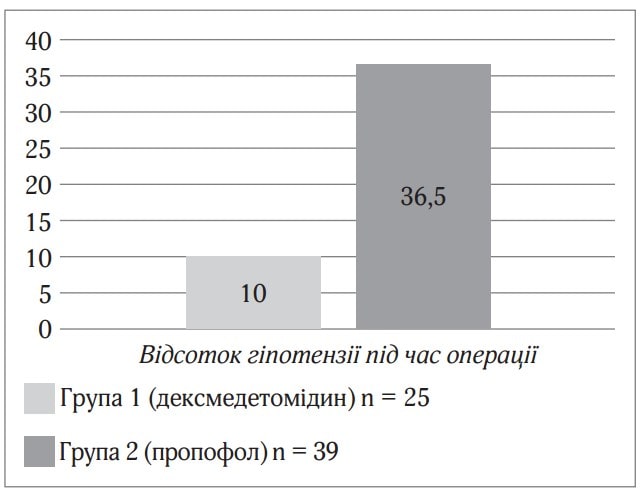
Рис.1
Цільові значення седації дексмедетомідином у 4–5 балів за шкалою Рамсея при проведенні спінальної анестезії майже не викликає розладів дихання, в той час як седація пропофолом викликає розлади дихання у вигляді помірної гіпоксемії (зниження SpO2 до 91–93 %) у 21 % пацієнтів і вираженої гіпоксемії (зниження SpO2 нижче 91 % було у 14 пацієнток) у 35,9 % пацієнток (рис. 2).
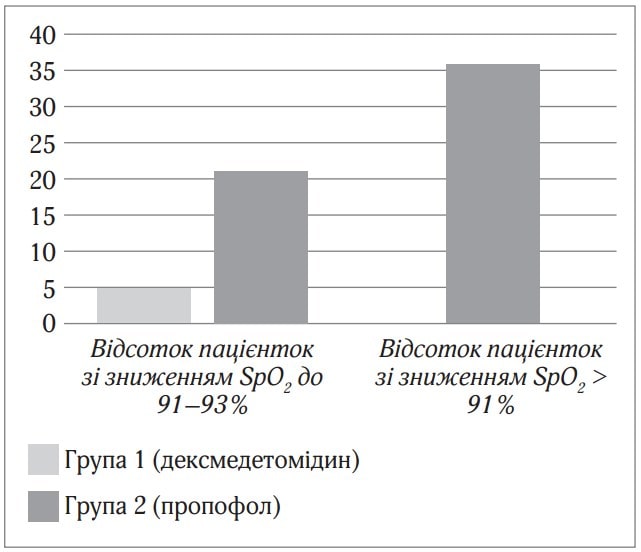
Рис.2
Седація дексмедетомідином при проведенні спінальної анестезії після пробудження не викликала епізодів ажитації, в той час як седація пропофолом викликала епізоди ажитації у 12,8 % пацієнтів. Запаморочення при седації дексмедетомідином виникало на 33,4 % рідше, ніж при седації на основі пропофолу (рис. 3).
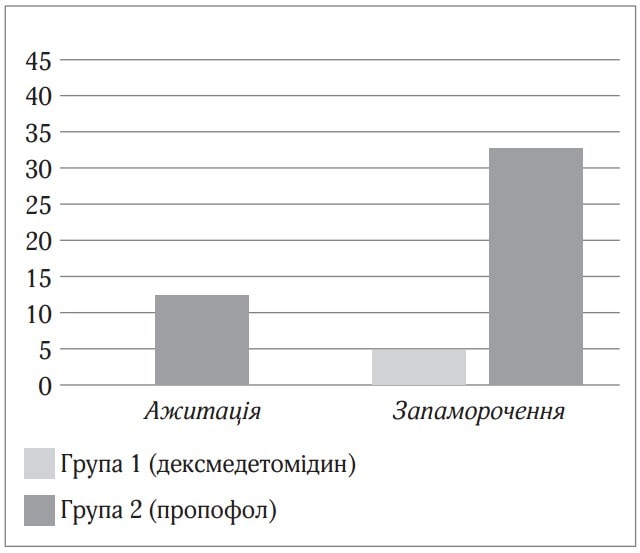
Рис.3
Відмінності між групами за інтенсивністю больового синдрому протягом перших 12 год можна також пояснити наявністю у дексмедетомідину самостійноїаналгетичної дії, що описано в багатьох публікаціях [8, 9]. Виявлена різниця вираженості больового синдрому після операції, ймовірно, пов’язана з відсутністю у пропофолу анальгетичного ефекту, що також дозволяє зробити вибір на користь дексмедетомідину у хворих даної категорії (рис. 4)
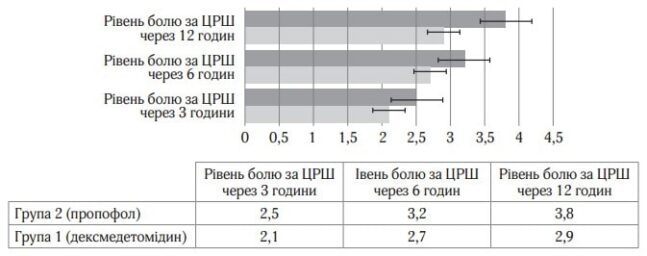
Рис.4. Оцінка болю в післяопераційному періоді
Висновок
При гінекологічних операціях в умовах реґіонарної анестезії кращою є седація дексмедетомідином, а не пропофолом. Седація Дексмедетомідином (Юрія-Фарм) веде до зменшення частоти когнітивних порушень у ранньому післяопераційному періоді, зниження інтенсивності больового синдрому, сприятливого впливу на відновлення й активацію після операції, а також асоціюється з меншою частотою розвитку гіпоксемії та артеріальної гіпотензії під час операції.
Автори:
Гріжимальський Є. В., Гарга А. Й., пологовий будинок “Лелека”, Київ
Література:
- Svetlov VA, Zaytsev AYu, Kozlov SP. Balanced anesthesia based on regional blockades: strategy and tactics [Sbalan-sirovannaya anesteziya na osnove regionarnykh blokad: strategiya i taktika]. Anesteziologiya i reanimatologiya. 2006;4:4–33. [In Russian]
- Precedex (dexmedetomidine). Hospira, Inc., Lake Forest, IL 60045 USA. Available from: http://medlibrary.org/lib/rx/meds/precedex/page/1–7/
- Candiotti KA, Bergese SD, Bokesch PM, Feldman MA, Wisemandle W, Bekker AY. Monitored Anesthesia Care with Dexmedetomidine: A Prospective, Randomized, Double-Blind, Multicenter Trial. Anesthesia & Analgesia [Internet]. Ovid Technologies (Wolters Kluwer Health); 2010 Jan;110(1):47–56. Available from: https://doi.org/10.1213/ane.0b013e3181ae08564.
- Bergese SD, Candiotti KA, Bokesch PM, Zura A, Wiseman-dle W, Bekker AY. A Phase IIIb, Randomized, Double-blind, Placebo-controlled, Multicenter Study Evaluating the Safety and Efficacy of Dexmedetomidine for Sedation During Awake Fiberoptic Intubation. American Journal of Ther-apeutics [Internet]. Ovid Technologies (Wolters Kluwer Health); 2010 Nov;17(6):586–95. Available from: https://doi.org/10.1097/mjt.0b013e3181d690725.
- Wu W, Chen Q, Zhang L, Chen W. Dexmedetomidine versus midazolam for sedation in upper gastrointestinal endosco-py. Journal of International Medical Research [Internet]. SAGE Publications; 2014 Feb 10;42(2):516–22. Available from: https://doi.org/10.1177/03000605135154376.
- Ebert TJ, Hall JE, Barney JA, Uhrich TD, Colinco MD. The Effects of Increasing Plasma Concentrations of Dexmede-tomidine in Humans. Anesthesiology [Internet]. Ovid Tech-nologies (Wolters Kluwer Health); 2000 Aug;93(2):382–94. Available from: https://doi.org/10.1097/00000542–200008000–000167.
- Krasenkova EA, Ovechkin AY, Pyregov AV. Influence of anesthetic techniques on occurrence of postoperative cognitive dysfunction in elderly patients undergoing gyne-cological surgery. Bulletin of Russian State Medical Univer-sity [Internet]. Pirogov Russian National Research Medical University; 2016;(4):51–5. Available from: https://doi.org/10.24075/brsmu.2016–04–088.
- Karelov АE, Lebedinskiy KM, Buravtsov VI. Anesthetic, analgetic, hypnotic – are the definitions important?. Anes-teziologii I Reanimatologii, 2015;12(5):3–11. [In Russian]
- Kulikov АS, Lubnin АYu. Dexmedetomidine: new oppor-tunities in the anesthesiology. Anesteziologiya i Reanima-tologiya. 2013;(1):37–41. [In Russian]