Обґрунтування респіраторної цитопротекції при бронхіальній астмі у дітей

Резюме
Мета роботи. Покращити результати лікувально-профілактичних заходів при бронхіальній астмі (БА) у дітей шляхом доповнення комплексу базисної терапії інгаляційним введенням препарату ектоїну («Ектобріс»).
Матеріал та методи. Проведено комплексне клініко-параклінічне обстеження 78 дітей шкільного віку, хворих на БА. Сформовано 2 клінічні групи. І групу сформували 47 дітей (середній вік – (12,2 ± 0,5) роки, частка хлопчиків – 78,7 %), які отримували стандартне базисне лікування з приводу бронхіальної астми. До складу ІІ групи увійшов 31 хворий на БА (середній вік – (11,7 ± 0,6) роки (p > 0,05), частка хлопчиків – 67,7 % (p > 0,05)), до складу базисної терапії якого додавали інгаляційний препарат «Ектобріс» (по 2,5 мл в контейнерах для небулізації 2 рази/день впродовж 10 днів). За основними клінічними характеристиками групи спостереження були співставимі.
Результати. Нами встановлено, що у хворих на астму дітей, які в комплексному базисному лікування отримували інгаляції «Ектобрісу», відбулося збільшення середнього балу за опитувальником АСТ, що свідчило про покращення контролю захворювання (зростання абсолютного ризику (ЗАР) – 53,8 %, зростання відносного ризику (ЗВР) – 69,9 % (95%ДІ: 59,9-78,7) при мінімальній кількості хворих (МКХ) – 1,4 (95%ДІ: 0,04-6,5).
Нами також показано, що використання 10-денного курсу інгаляцій супроводжувалося зменшенням запальної десквамації епітелію (за даними назоцитограми), а зростання шансів досягнення мінімальної кількості злущених епітеліоцитів (< 5 %) у назальному епітелії характеризувалося: ЗАР – 32,0 %, ЗВР – 52,4 % (95%ДІ: 42,2-62,5), МКХ – 1,9 (95%ДІ: 0,1-7,2) а також дозволило зменшити показники неспецифічної гіперсприйнятливості дихальних шляхів до непрямих бронхоспазмогенних чинників.
Висновки. Додавання до стандартної базисної протизапальної терапії БА інгаляцій «Ектобрісу» дозволило покращити контроль над захворюванням, зменшити показники неспецифічної гіперспринятливості дихальних шляхів до фізичного навантаження.
Ключові слова: бронхіальна астма, діти, ектоїн.
Вступ
Бронхіальна астма (БА) впродовж останніх десятиліть набула ознак однієї з найбільш розповсюджених форм хронічної патології дитячого віку [14]. Попри масштабні та поглиблені та скоординовані дослідження, не лише окремі, але й числення аспекти даної патології, залишаються невирішеними як з практичної, так і з наукової точки зору. До таких достеменно нерозв’язаних епіфеноменів астми відносять, зокрема, невід’ємний її атрибут як гіперсприйнятливість дихальних шляхів.
Гіперсприйнятливість дихальних шляхів (ГСДШ) – це стан, котрий характеризується підвищеною їх реакцією на різноманітні стимули, які призводять до обструкції бронхів при потужності впливу, що не викликає подібної реакції у більшості здорових осіб [8]. Умовно виділяють специфічну (до алергенів) та неспецифічну (до різних хімічних, фізичних та фармакологічних подразників) гіперсприйнятливість. Гіперсприйнятливість бронхів є настільки характерною для хворих на бронхіальну астму, що входить до визначення даного захворювання.
Проте наразі має місце певна нечіткість уявлень стосовно даного феномену, яка знаходить своє відображення у різноманітних термінах. Так, поряд з найбільш часто вживаним терміном «гіперсприйнятливість дихальних шляхів» (ГСДШ) та його синонімом „гіперсприйнятливість бронхів” (ГСБ), доволі часто використовуються також інші терміни, зокрема, „гіперчутливість”, „гіперреактивність”, „гіпервідповідь” дихальних шляхів (бронхів).
Хоча під „чутливістю” у суворому розумінні слова розуміють порогову дозу речовини, котра знижує питому бронхіальну прохідність на 20 %, а під „реактивністю” – кут нахилу кривої „доза-ефект”, численні автори все ж використовують ці терміни як синоніми „гіперсприйнятливості”.
Для вивчення ГСДШ у дитячому віці використовуються бронхопровокаційні тести з інгаляціями різних подразників, котрі поділяють на прямі (гістамін, метахолін) і непрямі (неізотонічні аерозолі, фізичне навантаження, холодне та сухе повітря, ізокапнічна гіпервентиляція, аденозин, брадикінін). Прямі стимули викликають безпосередній спазм бронхіальних м´язів (гістамін, метахолін), а непрямі стимули (фізичне навантаження, холодне повітря, гіпертонічні розчини, аденозин) опосередковано викликають бронхоспазм шляхом активації опасистих клітин та епітелію судин, виділення медіаторів запаленні і вмикання нейрогенних механізмів [20].
Оскільки фармакологічні провокаційні проби з гістаміном та метахоліном є більш стандартизованими, ніж непрямі інгаляційні тести, вони частіше використовується для клінічних і епідеміологічних досліджень, оскільки володіють більшою чутливістю, а проба з фізичним навантаженням – більшою специфічністю. Зазвичай для цих досліджень використовують концентрації (дози) вказаних фармакологічних подразників, які знижують ОФВ1 до 20 % від вихідної (РС20Н, РD20Н).
Так, проведене у попередні роки на нашій кафедрі дослідження, до якого було залучено 111 хворих на бронхіальну астму дітей, середній вік – 12,4 роки (95% ДІ 11,9-13,0), середня тривалість захворювання – 6,3 роки (95% ДІ 5,6-7,0)) показало, що при розподілі за тяжкістю персистування астми у хворих (легка-середньоважка – важка) на рівні 17,1% – 45,9% – 37,0% відповідно, високий ступінь ГСДШ до гістаміну (менше 0,5мг/мл) виявлений у (47,7 ± 4,8) % дітей, помірна гіперчутливість (0,5-2,0 мг/мл) – у (28,0 ± 4,3) % хворих, а відносно низька (більше 2,0 мг/мл) – у 24,3±4,2% спостережень.
При цьому низька лабільність бронхів (менше 15%) у провокаційній пробі з дозованим фізичним навантаженням та інгаляцією сальбутамолу відмічена у 36,0±4,6% дітей, помірна (15-29%) – у 41,4±4,7% випадків, а висока (більше 30%) – у 22,6±4,0% спостережень [1].
Попри те, що ГСДШ зазвичай асоціює з їх хронічним запаленням та атопією, взаємозв’язок даних характерних епіфеноменів бронхіальної астми починають осмислювати лише останнім часом. Хронічне алергічне запалення підвищує сприйнятливості та реактивності дихальних шляхів, що проявляється повторюваними епізодами хрипів, утруднення дихання, кашлю та стисненням у грудній клітці.
Запалення супроводжується набряком слизової, призводить до посиленого ангіогенезу з розширенням і застійними явищами, а також гіпертрофії та гіперплазії гладкої мускулатури, потовщенню ретикулярної базальної мембрани, що сприяє потовщенню бронхіальної стінки, обмеженню повітряного потоку – розвитку ремоделінгу. Запалення характеризується змінами респіраторного епітелію [5] асоціюється із дисфункцією рецепторів епідермального фактору росту (EGFR), порушуючи їх регуляторну функцію і підтримання нормальних процесів реепітелізації [4].
Не дивлячись на невирішеність питання про взаємодію алергічного запалення та ГСДШ у розвиткові бронхіальної астми, отримані дані дають можливість не тільки більш диференційованого підходу до проведення протизапального лікування цього захворювання, але й дозволяють розробляти нові напрямки в терапії БА.
При оцінці ефективності протизапального лікування бронхіальної астми слід брати до уваги, що інгаляційні глюкокортикостероїди, мабуть, здатні дозозалежно зменшувати лише ту складову ГСДШ, котра зумовлена хронічним запаленням бронхів; а захист епітелію від впливу алергенів та інших чинників, які виступають тригерами нападів [9], на сьогодні видається перспективним напрямком у лікуванні та профілактиці загострень захворювання.
Екстремоліт ектоїн є одним із таких перспективних, альтернативних, нефармакологічних варіантів лікування пацієнтів з алергічними захворюваннями респіраторної системи. ектоїн – осмоліт з низькою молекулярною масою, який утворюється екстремофільними бактеріями і захищає біологічні молекули від зовнішніх впливів, таких як екстремальна температура, тиск, концентрація солі та ультрафіолетове випромінювання.
Ектоїн захищає макромолекули, призводить до стабілізації нативної форми білків, та збільшення текучості ліпідних мембран [10], що призводить до підвищення стійкості мембранного бар’єру до різних стресових факторів Ектоїн ® є сумісною розчиненою речовиною, яка має властивості захисту мембрани та зменшення запалення, та згідно сучасних даних, представляє альтернативний варіант немедикаментозного лікування алергії.
Так, клінічну ефективність ектоїну дослідники підтвердили у лікуванні алергічного риніту [22], оскільки ектоїн викликав клінічно значуще покращення симптомів алергічного риносинуситу порівняно до плацебо. Пастилки Ектоїн ® у багатоцентровому, проспективному, рандомізованому, контрольованому дослідженні продемонстрували ефективність в усуванні алергічних орофарингеальних симптомів при алергічному риніті та визнані безпечним і ефективним нефармакологічним варіантом його лікування [15].
Виходячи з цього, представлялося доцільним вивчити ефективність і безпечність препарату, що містить ектоїн (перший в Україні респіраторний цитопротектор «Ектобріс») у лікуванні хворих на бронхіальну астму дітей шкільного віку.
Мета роботи: покращити результати лікувально-профілактичних заходів при бронхіальній астмі у дітей шляхом доповнення комплексу базисної терапії інгаляційним введенням препарату ектоїну («Ектобріс»).
Матеріал і методи дослідження
В умовах ОКНП «Чернівецька обласна дитяча клінічна лікарня» проведено комплексне обстеження в міжприступному періоді 78 дітей шкільного віку, хворих на БА. Методом випадкової вибірки дітей розподілила на дві клінічні групи порівняння. Першу (І) групу сформували 47 дітей, які отримували стандартне базисне лікування з приводу бронхіальної астми. До складу ІІ групи увійшов 31 хворий на БА, до складу базисної терапії якого додавали інгаляційний препарат «Ектобріс» (по 2,5 мл в контейнерах для небулізації 2 рази/день впродовж 10 днів).
Для оцінки ефективності запропонованого лікування оцінювали динаміку клінічних змін з оцінкою тяжкості персистування та контрольованості симптомів з використанням опитувальника АСТ (Аsthma Сontrol Тest) для дітей до 11 років та 12 років і старше [17]. Загальна сума балів, що перевищувала 20, – свідчила про повний контроль, від 16 до 19 балів – про частковий контроль, 15 і менше балів – про відсутність контролю над захворюванням.
Для визначення гіперсприйнятливості бронхів до непрямих провокаційних стимулів застосовувалася проба з фізичним навантаженням (дозований біг) із наступною інгаляцією бронходилятаторів (200 мкг сальбутамолу) [23]. При цьому лабільність дихальних шляхів за даними форсованого видиху на першій секунді (ОФВ1) оцінювали за допомогою «показника лабільності бронхів» (ПЛБ), що є сумою величин індексу бронхоспазму (ІБС, %) та індексу бронходиляції (ІБД, %).
Для дослідження характеру та виразності пізньої фази алергічного запалення дихальних шляхів вивчали склад риноцитограми [11] на підставі цитологічного аналізу [6] з фарбуванням назального мазка-відбитка гематоксиліном і еозином. Виходили з того, що еозинофільна інфільтрація слизової та/або накопичення цих ефекторних гранулоцитів у дихальних шляхах, вважається корисним біомаркером алергічної астми [7, 19].
Цитологічне дослідження відбитку слизової верхніх дихальних шляхів обрано через наявність певного обмеження щодо використання з цією метою мокротиння через технічні труднощі з отриманням, особливо у поза приступному періоді [24].
Діагноз і тяжкість персистування астми у дітей груп порівняння визначали згідно сучасних критеріїв і настанов [2], а одним із критеріїв залучення у дослідження була тривалість захворювання, що перевищувала 2 роки.
Загальна характеристика хворих, які увійшли до груп порівняння, наведена у таблиці 1.
Таблиця 1. Загальна характеристика хворих
|
Групи |
Середній вік, роки |
Частка хлопчиків, % |
Частка хворих на БА, % |
Частка хворих на БА+АР,% |
|
І група |
12,2 ±0,5 |
78,7 |
42,6 |
57,4 |
|
ІІ група |
11,7±0,6 |
67,7 |
35,5 |
64,5 |
|
р |
>0,05 |
>0,05 |
>0,05 |
>0,05 |
Примітка: р – критерій Ст‵юдента; БА – бронхіальна астма; АР – алергічний риніт.
Статистичний аналіз здійснювали за допомогою програми Statistica 8,0 StatSoft Inc. Отримані результати дослідження аналізували методом біостатистики та клінічної епідеміології з використанням при нормальному розподілі параметричного аналізу, а в малих вибірках – непараметричних методів обчислення.
Кількісні ознаки наведені у вигляді M ± σ (середнє арифметичне ± середньоквадратичне відхилення). Ефективність запропонованого лікування визначали за зростанням показників абсолютного (ЗАР) та відносного ризиків (ЗВР) позитивної події, а також мінімальною кількістю хворих, яких необхідно пролікувати для отримання одного позитивного результату (МКХ).
Дослідження проведене з дотриманням вимог нормативно-правової бази з біоетики: Женевської та Гельсінської декларацій (World Medical Association Declaration of Helsinki, 1994, 2000, 2008), Міжнародного Кодексу медичної етики, Міжнародного Керівництва СIOМS (1993 р.). На участь дитини у дослідженні отримували інформовану згоду батьків або опікунів.
Результати та обговорення
При проведенні на початку дослідження порівняльного аналізу щодо особливостей персистування астми у дітей груп порівняння нами не встановлено значущих розбіжностей. На рис.1 наведений розподіл тяжкості перебігу астми у дітей клінічних груп порівняння, визначеної на початку дослідження.
Рис 1. Розподіл тяжкості персистувального перебігу бронхіальної астми у дітей груп порівняння
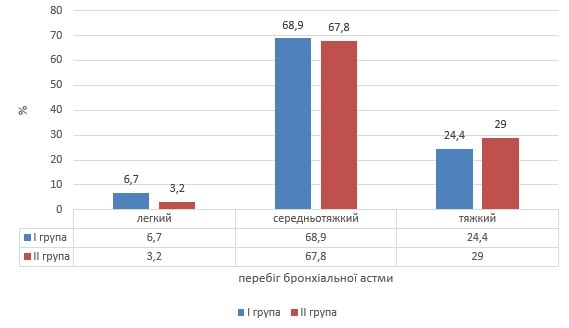 Як видно з наведених даних, статистично вірогідних розбіжностей за важкістю персистування астми в групах порівняння не відмічено. Разом із тим, частка випадків легкого персистування астми була вдвічі меншою у ІІ клінічній групі.
Як видно з наведених даних, статистично вірогідних розбіжностей за важкістю персистування астми в групах порівняння не відмічено. Разом із тим, частка випадків легкого персистування астми була вдвічі меншою у ІІ клінічній групі.
По завершенні курсу лікування через 3 місяці періоду клінічного благополуччя у групах порівняння за допомогою опитувальника АСТ для дітей до 12 років та старше 12 років оцінювали стан контролю захворювання, результати якого порівняно з вихідними даними наведені на рис. 2.
Рис. 2. Оцінка контрольованості бронхіальної астми за АСТ-опитувальником у пацієнтів груп порівняння в динаміці лікування
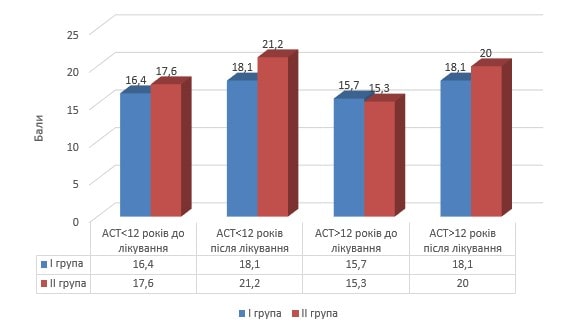 Згідно наведених даних, у ІІ групі хворих на астму дітей, які в комплексному базисному лікування отримували інгаляції «Ектобрісу», відбулося збільшення середнього балу за опитувальником АСТ, що свідчило про покращення контролю захворювання. Так, шанси утримати контроль захворювання з оцінкою за АСТ ≥19 балів у дітей віком до 12 років порівняно до однолітків І групи становили: зростання абсолютного ризику (ЗАР) – 53,8 %, зростання відносного ризику (ЗВР) – 69,9 % (95%ДІ: 59,9-78,7) при мінімальній кількості хворих (МКХ) – 1,4 (95%ДІ: 0,04-6,5).
Згідно наведених даних, у ІІ групі хворих на астму дітей, які в комплексному базисному лікування отримували інгаляції «Ектобрісу», відбулося збільшення середнього балу за опитувальником АСТ, що свідчило про покращення контролю захворювання. Так, шанси утримати контроль захворювання з оцінкою за АСТ ≥19 балів у дітей віком до 12 років порівняно до однолітків І групи становили: зростання абсолютного ризику (ЗАР) – 53,8 %, зростання відносного ризику (ЗВР) – 69,9 % (95%ДІ: 59,9-78,7) при мінімальній кількості хворих (МКХ) – 1,4 (95%ДІ: 0,04-6,5).
Збільшення шансів даної події у представників ІІ групи віком старше 12 років відносно однолітків І групи становили: ЗАР – 66,6 %, ЗВР – 83,2 % (95%ДІ: 74,4-90,0) при МКХ – 1,2 (95%ДІ: 0,03-5,9). Таким чином, практично у кожного хворого на тлі прийому «Ектобрісу» досягалося покращення контролю над симптомами астми. Так, на рис. 3 наведений порівняльний розподіл за частотою денних симптомів бронхіальної астми у дітей ІІ групах до та після проведеного курсу базисного лікування з додаванням «Ектобрісу».
Рис. 3. Вплив «Ектобрісу» на частоту денних симптомів астми у дітей віком до 12 років порівняно до анамнестичних даних
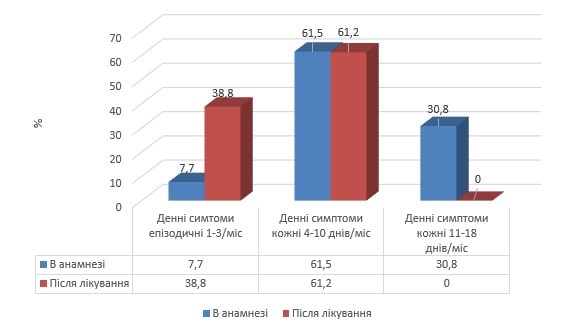 Під впливом комплексної базисної терапії з додаванням «Ектобрісу» серед дітей ІІ групи віком менше 12 років у 5 разів зросла частка випадків винятково епізодичних денних симптомів, натомість, часті денні симптоми по завершенню курсу базисної терапії не реєструвалися взагалі. Аналогічні позитивні зміни відбулися і серед школярів віком старше 12 років на тлі додавання «Ектобрісу» до комплексу базисної терапії (рис. 4).
Під впливом комплексної базисної терапії з додаванням «Ектобрісу» серед дітей ІІ групи віком менше 12 років у 5 разів зросла частка випадків винятково епізодичних денних симптомів, натомість, часті денні симптоми по завершенню курсу базисної терапії не реєструвалися взагалі. Аналогічні позитивні зміни відбулися і серед школярів віком старше 12 років на тлі додавання «Ектобрісу» до комплексу базисної терапії (рис. 4).
Рис. 4. Вплив Ектобрісу на частоту денних симптомів астми у дітей віком старше 12 років порівняно до анамнестичних даних
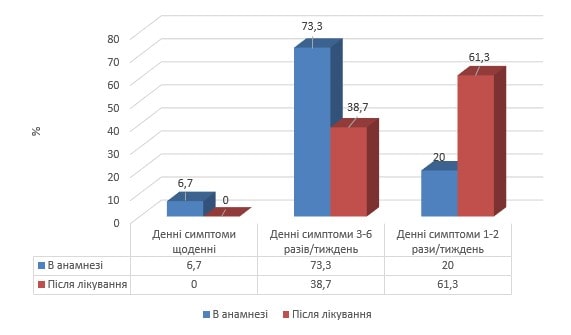 Представлені клінічні дані свідчать про те, що під впливом базисного лікування із додаванням інгаляцій «Ектобрісу» серед хворих віком старше 12 років у 3 рази зросла частка реєстрації винятково епізодичних денних симптомів бронхіальної астми, а щоденні симптоми у даних хворих по завершенню курсі лікування не реєструвалися взагалі.
Представлені клінічні дані свідчать про те, що під впливом базисного лікування із додаванням інгаляцій «Ектобрісу» серед хворих віком старше 12 років у 3 рази зросла частка реєстрації винятково епізодичних денних симптомів бронхіальної астми, а щоденні симптоми у даних хворих по завершенню курсі лікування не реєструвалися взагалі.
З метою вивчення особливостей впливу інгаляцій «Ектобрісу» в комплексному базисному лікуванні дітей шкільного віку, хворих на БА, зокрема, із окремим її фенотипами (еозинофільний, нееозинофільний/нейтрофільний) [3], нами проведене цитологічне дослідження мазка-відбитка зі слизової носа (риноцитограма, назоцитограма) на початку і по завершенню курсу лікування дітей ІІ групи (рис. 5).
Рис. 5. Вміст гранулоцитів у слизовій носа (назоцитограма) в динаміці лікування
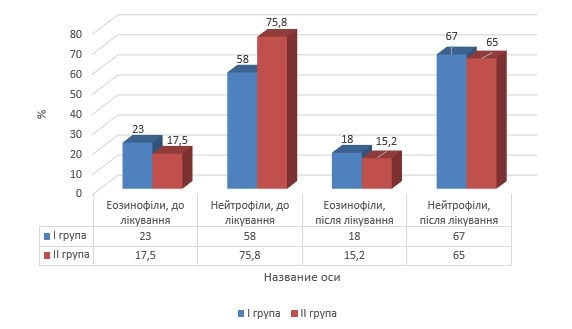 Даний метод дослідження виявився доволі інформативним [18] та дозволив дійти висновку, що під впливом запропонованого комплексного лікування із додаванням інгаляцій «Ектобрісу» відносний вміст нейтрофілів у назальному секреті досягнув нормальних показників та зменшився відносний вміст еозинофілів.
Даний метод дослідження виявився доволі інформативним [18] та дозволив дійти висновку, що під впливом запропонованого комплексного лікування із додаванням інгаляцій «Ектобрісу» відносний вміст нейтрофілів у назальному секреті досягнув нормальних показників та зменшився відносний вміст еозинофілів.
У наукових дослідженнях останніх років уміст назальних еозинофілів 20 % визнається дискримінаційної точкою та найбільш надійним біологічним маркером атопії, який дозволяє прогнозувати відповідь на стероїдну терапію з 94 % чутливістю та 77 % специфічністю [21].
З огляду на дані наукових досліджень, які свідчать про гіршу відповідь на стероїну терапію пацієнтів із неатопічним фенотипом запалення слизової, зумовленим інфільтрацією нейтрофілами [16], отримані результати представляються особливо цінними стосовно перспектив використання інгаляцій «Ектобрісу» у дітей із не еозинофільним/нейтрофільним фенотипом бронхіальної астми [25].
Вивчено вплив доповнення базисної терапії інгаляціями «Ектобрісу» на десквамацію епітелію слизових оболонок дихальних шляхів. Показано, що використання 10-денного курсу інгаляцій супроводжувалося зменшенням запальноі десквамації епітелію (за даними назоцитограми), а зростання шансів досягнення мінімальної кількості злущених епітеліоцитів (< 5 %) у назальному епітелі) характеризувалося: ЗАР – 32,0 %, ЗВР – 52,4 % (95%ДІ: 42,2-62,5), МКХ – 1,9 (95%ДІ: 0,1-7,2).
Отже, одержані дані дозволяють констатувати, що запропоноване лікування у кожного другого хворого дозволили значно зменшити виразність десквамації епітеліоцитів, зумовленої хронічним алергічним запаленням.
Важливим представлявся аналіз змін у показниках ГСДШ до бронхопровокаційної проби з дозованим фізичним навантаженням і наступною інгаляцією 200 мкг сальбутамолу (табл. 2).
Таблиця 2. Показники лабільності бронхів у відповідь на фізичне навантаження в динаміці лікування із використанням «Ектобрісу»
|
Динаміка показників |
Індекс бронхоспазму, (різниця ОФВ1),% |
Індекс бронходилятації, (різниці ОФВ1),% |
|
Обстеження в анамнезі |
9,0 |
20,5 |
|
Обстеження після курсу «Ектобрісу» |
6,5 |
16,2 |
|
р |
<0,05 |
<0,05 |
Примітка: р – критерій Ст‵юдента; ОФВ1 – об‵єм форсованого видиху на 1 секунді.
Як видно з наведених даних, додавання до стандартної базисної протизапальної терапії бронхіальної астми інгаляцій «Ектобрісу» дозволило зменшити показники неспецифічної ГСДШ до непрямого бронхоспазмогенного чинника – фізичного навантаження, та, в цілому, лабільність бронхів, високі показники якої, за даними досліджень, асоціюють з тяжким персистуванням астми у дітей [12].
Насамкінець, слід зазначити високу прихильність до лікування, відсутність побічних ефектів та гарну оцінку батьками і хворими додавання інгаляцій «Ектобрісу» до стандартної базисної терапії дитячої бронхіальної астми.
Автори:
- Колоскова Олена Костянтинівна – д.мед.н., проф., зав. кафедри педіатрії та дитячих інфекційних хвороб Буковинського державного медичного університету, Чернівці, Україна.
- Тарнавська Світлана Іванівна – к.мед.н., доц. каф. педіатрії та дитячих інфекційних хвороб Буковинського державного медичного університету, Чернівці, Україна.
Висновки:
- Виходячи з отриманих результатів порівняльного дослідження можна стверджувати, що доповнення стандартного базисного протизапального лікування препаратом ектоїну – «Ектобрісом» демонструє кращі результати в оптимізації контролю дитячої астми: у дітей віком до 12 років – ЗАР – 53,8%, ЗВР – 69,9%, МКХ – 1,4 , а у хворих віком старше 12 років ЗАР – 66,6%, ЗВР – 83,2 % , МКХ – 1,2.
- Під впливом комплексного лікування із доповненням інгаляціями «Ектобрісу» відбувається збільшення частки хворих з епізодичними денними симптомами астми у 5 разів у віці до 12 років та у 3 рази у віці старше 12 років, а щоденних симптомів астми не відмічається взагалі.
- У дітей, які в складі базисної терапії астми отримували інгаляції «Ектобрісу», нормалізується вміст нейтрофілів та зменшується кількість назальних еозинофілів у мазку-відбитку зі слизової носа, та зростають шанси запалення слизової з десквамацією епітеліоцитів: ЗАР – 32,0%, ЗВР – 52,4%, МКХ – 1,9. (95%ДІ: 0,1-7,2).
- Інгаляції «Ектобрісу» в складі базисної протизапальної терапії добре переносились, не мали побічних ефектів та супроводжувалися статистично достовірним зменшенням неспецифічної гіперсприйнятливості до фізичного навантаження, а також показників лабільності бронхів.
Література:
- Ажімі Мухамед Соф′єн Б.А. Гіперреактивність бронхів у дітей, хворих на бронхіальну астму (імунологічна характеристика, клінічне значення). Запоріжський медичний журнал. 2005. 5 (32): 107-108.
- Наказ МОЗ України 23.12.2021 № 2856 «Про затвердження уніфікованого клінічного протоколу первинної та вторинної (спеціалізованої) медичної допомоги “Бронхіальна астма у дітей”. Режим доступу: rada.gov.ua/rada/show/v2856282-21
- Akar-Ghibril N., Casale T., Custovic A., Phipatanakul W. Allergic Endotypes and Phenotypes of Asthma. J Allergy Clin Immunol Pract. 8(2):429-440. doi: 10.1016/j.jaip.2019.11.008.
- Arteaga-Badillo D.A., Portillo-Reyes J., Vargas-Mendoza N., Morales-González J.A., Izquierdo-Vega J.A., Sánchez-Gutiérrez M., Álvarez-González I., Morales-González Á., Madrigal-Bujaidar E., Madrigal-Santillán E. Asthma: New Integrative Treatment Strategies for the Next Decades. Medicina (Kaunas). 2020.28;56(9):438. doi: 10.3390/medicina56090438.
- Agache I., Akdis C., Jutel M., Virchow J.C. Untangling asthma phenotypes and endotypes. Allergy. 2012.67(7):835-46. doi: 10.1111/j.1398-9995.2012.02832.x.
- Ciofalo A., Cavaliere C., Incorvaia C., Plath M., Ridolo E., Pucciarini F., Altissimi G., Greco A., de Vincentiis M., Masieri S. Diagnostic performance of nasal cytology. Eur Arch Otorhinolaryngol. 279(5):2451-2455. doi: 10.1007/s00405-021-07044-5.
- Diamant Z., Vijverberg S., Alving K., Bakirtas A., Bjermer L., Custovic A., Dahlen S.E., Gaga M., Gerth van Wijk R., Giacco S.D., Hamelmann E., Heaney L.G., Heffler E., Kalayci Ö., Kostikas K., Lutter R., Olin A.C., Sergejeva S., Simpson A., Sterk P.J., Tufvesson E., Agache I., Seys S.F. Toward clinically applicable biomarkers for asthma: An EAACI position paper. 2019. 74(10):1835-1851. doi: 10.1111/all.13806.
- Durán R. Pathophysiology of asthma: A current view. Col. Neumol. 2015. 27:226–230.
- Halken S. Prevention of allergic disease in childhood: clinical and epidemiological aspects of primary and secondary allergy prevention. Pediatr Allergy Immunol. 2004.15 (Suppl 16):4-5, 9-32. doi: 10.1111/j.1399-3038.2004.0148b.x.
- Harishchandra R.K., Sachan A.K., Kerth A., Lentzen G., Neuhaus T., Galla H.J. Compatible solutes: ectoine and hydroxyectoine improve functional nanostructures in artificial lung surfactants. Biochim Biophys Acta. 2011. 1808(12):2830-40. doi: 10.1016/j.bbamem.2011.08.022.
- Heffler E., Landi M., Caruso C., Fichera S., Gani F., Guida G., Liuzzo M.T., Pistorio M.P., Pizzimenti S., Riccio A.M., Seccia V., Ferrando M., Malvezzi L., Passalacqua G., Gelardi M. Nasal cytology: Methodology with application to clinical practice and research. Clin Exp Allergy. 2018. 48(9):1092-1106. doi: 10.1111/cea.13207.
- Garas M., Sazhyn S., Lekhkun G., Goncharuk R., Gorenko N. Indices of nonspecific bronchial reactivity in severe asthma phenotype determination in schoolchildren. Wiad Lek. 2018. 71(8):1537-1540.
- Gauvreau G.M., Brannan J.D. Provoked models of asthma: what have we learnt? Clin Exp Allergy. 39(2):181-92. doi: 10.1111/j.1365-2222.2008.03172.x.
- Global Strategy for Asthma Management and Prevention Global Initiative for Asthma (GINA) 2020. [(accessed on 11 July 2020)]; Available online: org/wp-content/uploads/2020/06/GINA-2020-report_20_06_04-1-wms.pdf.
- Khachouk R., Pieper-Fürst U., Acikel C., Kolot C., Bilstein A., Mösges R. Effectiveness of Ectoin lozenges on oropharyngeal allergic symptoms. Clin Transl Allergy. 2022 Jan 6;12(1):e12095. doi: 10.1002/clt2.12095.
- Kirtsreesakul V., Hararuk K., Leelapong J., Ruttanaphol S. Clinical efficacy of nasal steroids on nonallergic rhinitis and the associated inflammatory cell phenotypes. Am J Rhinol Allergy. 29(5):343-9. doi: 10.2500/ajra.2015.29.4234.
- Liu A.H. , Zeiger R.S. , Sorkness C.A. The Childhood Asthma Control Test: Retrospective determination and clinical validation of a cut point to identify children with very poorly controlled asthma. J. Allergy Clin. Immunol. 2010. 126:267–273.
- Lozano N.A., Saranz R.J., Lozano A., Bovina Martijena M.D.P., Ramirez M., Ponzio M.F., Berardi Y.V., Sosa A.G., Cóncari E. Análisis de la citología nasal en niños y adolescentes con rinitis [Analysis of nasal cytology in children and adolescents with rhinitis]. Rev Fac Cien Med Univ Nac Cordoba. 2017. 74(2):126-133.
- Murayama N., Murayama K. Nasal Discharge Eosinophils in Childhood Asthma Patients as a Predictive Factor for Persistent Asthma. Mediators Inflamm. 18:256-268. doi: 10.1155/2018/2563978.
- O’Byrne M., Gauvreau G.M., Brannan J.D. Provoked models of asthma: what have we learnt? Clin Exp Allergy. 2009.39(2):181-92. doi: 10.1111/j.1365-2222.2008.03172.x.
- Papadopoulou A., Lambidi S., Lagousi T., Syrrou M., Giannoula F., Staikou E., Kostaridou S., Mermiri D.T. Nasal eosinophilia as a preliminary discriminative biomarker of non-allergic rhinitis in every day clinical pediatric practice. Eur Arch Otorhinolaryngol. 280(4):1775-1784. doi: 10.1007/s00405-022-07704-0.
- Salapatek A.M., Werkhäuser N., Ismail B., Mösges R., Raskopf E., Bilstein A. Effects of ectoine containing nasal spray and eye drops on symptoms of seasonal allergic rhinoconjunctivitis. Clin Transl Allergy. 11(1):120-126. doi: 10.1002/clt2.12006.
- Silverman M., Anderson S.D. Standardization of exercise tests in asthmatic children. Arch. Dis. Child. 1972. 47:882-889.
- Simpson J.L., Yang I.A., Upham J.W., Reynolds P.N., Hodge S., James A.L., Jenkins C., Peters M.J., Jia G., Holweg C.T., Gibson P.G. Periostin levels and eosinophilic inflammation in poorly-controlled asthma. BMC Pulm Med. 30;16(1):67. doi: 10.1186/s12890-016-0230-4.
- Sydlik U., Gallitz I., Albrecht C., Abel J., Krutmann J., Unfried K. The compatible solute ectoine protects against nanoparticle-induced neutrophilic lung inflammation. Am J Respir Crit Care Med. 2009. 80(1):29-35. doi: 10.1164/rccm.200812-1911OC.


