Дексмедетомідин для седації в інтенсивній терапії (огляд літератури та клінічний досвід)
Резюме. Дексмедетомідин є доволі новим і перспективним препаратом у використанні в інтенсивній терапії та при оперативних втручаннях. Враховуючи те, що він є агоністом альфа-2-адренорецепторів, дексмедетомідин має аналгетичний, седативний ефект і впливає на показники гемодинаміки. Завдяки тому, що дексмедетомідин не має здатності пригнічувати дихання, він може використовуватись у пацієнтів з порушенням дихання. Дексмедетомідин має мінімальну кількість побічних ефектів та широкий спектр використання.
Ключові слова: дексмедетомідин, седація, біль, інтенсивна терапія, сон, делірій.
Актуальність
Дексмедетомідин є селективним агоністом альфа-2адренорецепторів з широким спектром фармакологічних властивостей. Він має симпатолітичний ефект завдяки зменшенню вивільнення норадреналіну з пресинаптичної ділянки симпатичних нервів. Седативний ефект обумовлений зниженням збудження в блакитній плямі стовбура головного мозку (ядро з переважанням норадренергічних нейронів). Дексмедетомідин має аналгетичний ефект.
Вплив на серцево-судинну систему має дозозалежний характер – при низькій швидкості інфузії переважає центральний ефект, що призводить до зниження ЧСС і артеріального тиску, а при використанні високих доз переважає периферична вазоконстрикція, що призводить до підвищення судинного опору, АТ і подальшого посилення брадикардії. Дексмедетомідин практично не має впливу на пригнічення дихання при застосуванні в якості монотерапії для здорових пацієнтів.
Фармакологічні властивості
Фармакологічні ефекти дексмедетомідину пов’язані зі стимуляцією альфа-2а-адренорецепторів, які розташовані в блакитній плямі стовбура мозку. Цей вплив порушує адренергічну передачу по висхідних нервових волокнах у вентролатеральному преоптичному ядрі таламуса (VLPO), що призводить до ГАМК-ергічного гальмування тубуломамілярного ядра (TMn). Дослідження доказують, що саме через цю систему реалізується механізм повільного сну [1, 2]. Таким чином, дексмедетомідин викликає сон, максимально наближений до фізіологічного. При введені препарату пацієнти спокійні і доступні для контакту, а після завершення контакту повертаються до сну [3].
Щодо анальгезуючого ефекту, то дослідники мають різні точки зору. При двох різних дослідженнях дексмедетомідин в одному викликав анальгезію, а в іншому дослідженні – ні. Використовувались методи теплового та електричного впливу на руку добровольців [4]. На основі цих двох досліджень можна зробити висновки, що інфузія дексмедетомідину не зменшує больову чутливість, але змінює сприйняття пацієнтом болю [5, 6].
Така дія, як підвищення толерантності, а не больового порогу, може пояснити описане раніше зменшення потреби в опіоїдах у післяопераційному періоді [7]. Враховуючи цих два дослідження, випливає, що дексмедетомідин не має аналгетичного єффекту, але здатний потенціювати дію інших аналгетичних препаратів, що, у свою чергу, може зменшувати потребу в опіоїдах і потенціювати дію деяких аналгетичних препаратів, таких як бупівакаїн.
Вплив дексмедетомідину на показники церебральної гемодинаміки вивчено не настільки добре. Проте є дані, що його системне введення призводить до зниження внутрішньочерепного і церебрального перфузійного тиску [8, 9]. Також у деяких випадках може спостерігатись зниження величини мозкового кровотоку та зниження потреби мозку в кисні [10]. Зазначено, що при введені дексмедетомідину картина ЕЕГ схожа до активності мозку під час фізіологічного сну [11].
Аналогічно добре впливає на рівень BIS. Дослідження на тваринах показали, що дексмедетомідин може зменшувати наслідки церебральної ішемії [12], а також здатний стимулювати утворення антиапоптичних факторів у нейронах [13]. Варто відзначити, що дані нейропротективні ефекти добре вивчені на тваринах, але застосування його у повсякденній практиці ще не досліджене.
Вплив на дихання. Дексмедетомідин із самого початку застосовувався як препарат для довготривалої седації в нейрохіругічному профілі у відділеннях інтенсивної терапії [19]. Дексмедетомідин має седативний і анксіоліотичний ефект, який дозволяє зберігати контакт з пацієнтом для оцінки неврологічного статусу, навіть в умовах ШВЛ.
Гемодинамічний ефект має двофазний характер. Використання дексмедетомідину в терапевтичних дозах, у вигляді інфузії, призводить до зниження систолічного і діастолічного тисків [14]. Проте при різкому болюсному введенні або при швидкій інфузії спостерігається підвищення АТ [15]; це пояснюється впливом препарату не на центральні, а на периферичні адренорецептори в судинах. При цьому дексмедетомідин викликає розвиток дозозалежної брадикардії.
Варто зазначити, що в терапевтичній дозі, при відсутності важкої патології серцево-судинної системи, зниження АТ не перевищує 10–15 %, а частота серцевих скорочень сягає не нижче 50 ударів за хвилину [16, 17].
У деяких рандомізованих дослідженнях було доведено, що дексмедетомідин здатний зменшувати частоту фібриляцій шлуночків [31, 32].
У зв’язку з цим більшість спеціалістів характеризують ефекти дексмедетомідину як стабілізацію гемодинаміки, через те що відбувається пригнічення активності симпатичної нервової системи. Навіть можна говорити про кардіопротективну дію для пацієнтів із серцево-судинною патологією, враховуючи, що післяопераційна тахікардія і гіпертонія являють велику небезпеку для даних категорій пацієнтів [18].
Застосування у ВАІТ
Було проведено масу досліджень для оцінки ефективності застосування дексмедетомідину у різних клінічних галузях, включаючи седацію для пацієнтів у критичному стані, для загальної й регіонарної анестезії, післяопераційної аналгезії, підтримки стабільної гемодинаміки при кардіохірургічних операціях [34].
Седативна стратегія у критично важких пацієнтів включає в себе незначну седацію з короткими періодами пробудження для оцінки неврологічних, когнітивних і дихальних функцій. Проте деякі седативні препарати, такі як лоразепам або пропофол, мають ряд побічних ефектів. На відміну від інших препаратів, дексмедетомідин має і седативний, і анальгетичний ефект. Механізм дії здійснюється через альфа-2ата альфа-2с-рецептори на пресинаптичному С-волокні і постсинаптичному спинномозковому нейроні [35]. Також дексмедетомідин подовжує тривалість моторної і сенсорної блокади місцевих анестетиків більш ніж у 2 рази.
У понад 66 % дексмедетомідин знижує потребу в післяопераційному морфіні [36]. Зменшення потреби в опіоїдах призводить до зменшеного пригнічення дихання; це може бути необхідним для пацієнтів, які дихають самостійно або які відлучаються від апарата ШВЛ.
Дексмедетомідин викликає унікальний стан, який має назву “кооперативна седація”. Внаслідок такого стану можна спостерігати за станом критично важких пацієнтів кожного дня, для оцінки рівня седації, аналгезії, неврологічних та дихальних функцій.
Корисним анальгетичним ефектом дексмедетомідину при застосуванні у ВАІТ є потенціювання опіоїдів і відсутність пригнічення дихання. У практичній роботі з пацієнтами, які страждають ожирінням, цей препарат може виявитись незамінним. Досить показовим є клінічний випадок ведення пацієнта масою 433 кг, який страждав також на обструктивне апное й легеневу гіпертензію [25]. Завдяки дексмедетомідину вдалось знизити кількість використання опіоїдних анальгетиків без пригнічення дихання. Дексмедетомідин досить успішно показав себе при використанні його під час фіброоптичної інтубації [26].
Підвищення толерантності до больових подразників, пригнічення симпатичної нервової системи та відсутність пригнічення дихальної функції роблять дексмедетомідин максимально хорошим препаратом для седації у ВАІТ [20]. Велике дослідження MIDEX, в якому брало участь 500 пацієнтів, підтвердило основні переваги дексмедетомідину перед мідазоламом [21].
Також дексмедетомідин показав переваги під час екстубації і своєчасності контакту з пацієнтом; при цьому частота побічних ефектів не перевищує таку у пропофолу [21]. У деяких випадках використання невеликих доз дексмедетомідину дозволяє досягати стабільних гемодинамічних показників під час операції та в післяопераційному періоді, особливо у дітей [22].
Крім того, значний метааналіз, проведений на основі 23 досліджень, які охопили понад 3000 пацієнтів, продемонстрував, що альфа-2-адреноміметики зменшують смертність і частоту інфаркту міокарда у пацієнтів після операцій на серці [23]. Але не варто забувати, що побічні ефекти дексмедетомідину, такі як гіпотензія, можуть призвести до підвищення ризику ішемії [24].
Післяопераційна фібриляція шлуночків – досить часте і розповсюджене ускладнення, яке підвищує смертність [29].
Властивості дексмедетомідину дуже важливі при седації у дітей. Цей препарат робить набагато безпечнішим такі дослідження, як КТ і МРТ у дітей, яким необхідна седація. Не відбувається пригнічення дихання, на відміну від пропофолу [27]. Також є дані про те, що дексмедетомідин зменшує збудження після використання севофлурану у дітей [28].
Проводилось дослідження, яке оцінювало частоту виникнення фібриляції передсердь (ФП) (AF) та шлуночкової тахікардії (ШТ) (VT). Даний метаналіз довів, що періопераційне використання дексмедетомідину при кардіохірургічних операціях у дорослих зменшувало частоту виникнення ФП та ШТ. Але, крім того, зменшення частоти виникнення ФШ після операції на сердці може бути не до кінця оцінене, оскільки пропофол використовувався в групі контролю [34].
В групу високого ризику також були включені пацієнти похилого віку, із цукровим діабетом і з важкою серцевою недостатністю [30].
Було проведено цікаве дослідження, яке показує ефективність використання дексмедетомідину в педіатричній кардіохірургії. За результатами даного дослідження можна зробити висновок, що дексмедетомідин не є препаратом для вирішення всіх питань у плані анестезіологічного забезпечення. Тим не менш, результати досліджень і клінічний досвід підтвердили співвідношення “ризик – користь” дексмедетомідину в дитячій кардіохірургії і встановлено його клінічне використання в якості премедикації, доповнення до загальної анестезії, а також у післяопераційному лікуванні. Більша частина цих досліджень носить характер спостереження.
Необхідні детальніші дослідження. Важливо зазначити: ряд експериментальних досліджень підтверджує думку про те, що поєднання протизапальних, цитопротективних, антиішемічних та симпатолітичних властивостей дексмедетомідину може виявляти значні захисні ефекти на життєво важливі органи. Тільки клінічні дослідження допоможуть оцінити молекулярні механізми дексмедетомідину для розуміння того, наскільки значний нейропротективний, кардіопротективний або ренопротективний ефект має дексмедетомідин.
Делірій є гострим психоневрологічним синдромом, який характеризується порушенням мислення, когнітивними дисфункціями й уражує до 80 % пацієнтів, які знаходяться у відділенні інтенсивної терапії [42]. Лікування делірію є критично важливим, тому що для важких пацієнтів це впливає на подальший їхній стан. На даний момент делірій має найбільший вплив на стан пацієнтів, тривалість перебування на апаратах штучної вентиляції легень, а також на тривалість перебування пацієнта у відділенні інтенсивної терапії [43, 44, 45].
Причини, які призводять або прискорюють виникнення делірію, включають в себе: седативні препарати, ГАМК-ергічні агенти, які порушують процеси пам’яті або сну [46]. Бензодіазепіни змінюють архітектуру сну і знижують фазу повільного сну [47]. Дексмедетомідин зберігає фазу повільного сну [48]. Таким чином, він менше впливає на когнітивну функцію. Є два клінічних дослідження, які підтверджують цю теорію. Дослідження SEDCOM показало меншу розповсюдженість делірію в групі, у якій застосовувався дексмедетомідин, ніж у групі, в якій застосовували мідазолам [49].
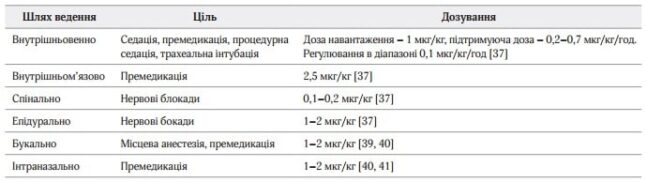
У дослідженні MEnDS оцінювалась кількість днів без делірію. В групі, у якій застосувався дексмедетомідин, кількість днів була вища, ніж у групі, в якій застосовувався лоразепам [41]. Дексмедетомідин має вплив на фазу сну; таким чином, сон стає більш фізіологічним, а седація більш заспокійливою; можна зробити висновок, що дексмедетомідин зменшує кількість випадків виникнення делірію у хворих, які перебувають у відділенні інтенсивної терапії. Режими дозування представлені в таблиці 1.
Таблиця 1. Шляхи ведення та режими дозування
Клінічний випадок № 1
Хворий 57 років перебував на стаціонарному лікуванні з приводу цукрового діабету. Хворому була показана операція – резекція правої стопи. Для місцевої анестезії було використано 20 мг розчину 0,25 % бупівакаїну, а для седації було використано дексмедетомідин (Юрія-Фарм) із дозою навантаження 1 мкг/кг протягом 10 хв. з наступною підтримуючою дозою 0,5 мкг/кг. Для моніторингу ступеня седації було використано BIS-монітор (див. рис. 1).
Судячи з моніторингу ступеня седації, завдяки дексмедетомідину було досягнуто достатній рівень для даного пацієнта (рис. 2). Хворий був доступний до контакту, проте після оцінки стану хворий одразу засинав. Після операції стан пацієнта був стабільний і він був переведений до палати післяопераційного нагляду.
Рис. 1. Рівень седації за даними моніторингу (клінічний випадок № 1)
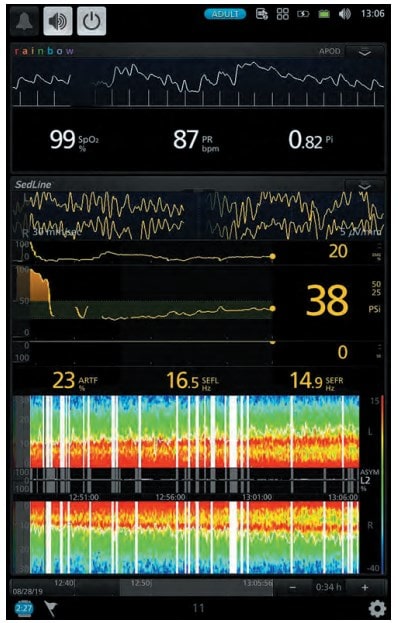
Рис. 2. Показники гемодинаміки під час дослідження (клінічний випадок № 1)
Клінічний випадок № 2
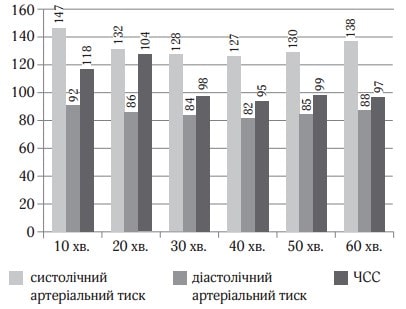
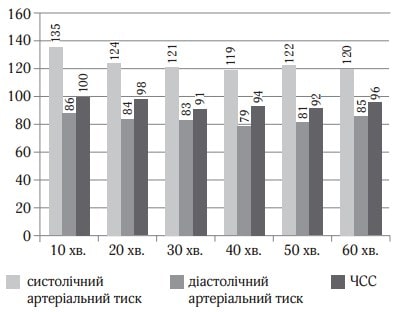
Хвора 67 років поступила у відділення для планової венектомії. Операція виконувалась під місцевою та загальною анестезією. Для місцевої анестезії було використано 15 мг 0,25 % розчину бупівакаїну. Для загальної анестезії застосовувався дексмедетомідин (Юрія-Фарм) з дозою навантаження 0,7 мкг/кг протягом 15 хв. з підтримуючою дозою 0,3 мкг/кг/год. Хвора була доступна контакту, після оцінки стану хвора знову засинала, рівень седації був достатній (рис. 3). Післяопераційний стан стабільний, вихід з наркозу був задовільний (рис. 4). Після операції хвора була переведена в палату післяопераційного нагляду.
Рис. 3. Рівень седації за даними моніторингу (клінічний випадок № 2)
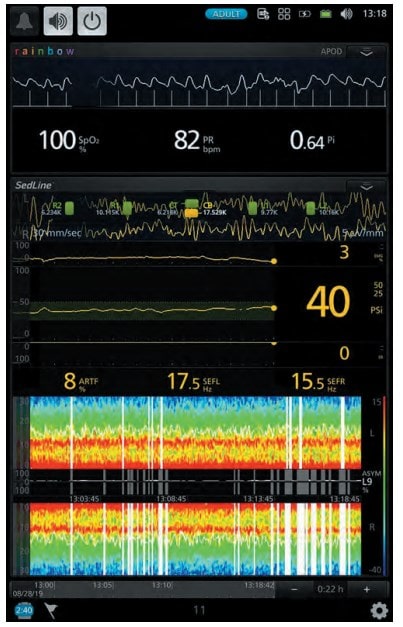
Рис. 4. Показники гемодинаміки під час дослідження (клінічний випадок № 2)
Висновки
Дексмедетомідин є селективним агоністом альфа-2адренорецепторів з широким спектром фармакологічних властивостей. Володіє симпатолітичним ефектом завдяки зменшенню вивільнення норадреналіну з пресинаптичної ділянки симпатичних нервів. Дексмедетомідин може використовуватись при різних станах в інтенсивній терапії, в тому числі й при різних оперативних втручаннях.
Дексмедетомідин не має впливу на дихання, тому його можна використовувати у пацієнтів з різними порушеннями дихальної системи. Мінімальна кількість побічних ефектів та широкий спектр використання роблять дексмедетомідин майже незамінним при седації у пацієнтів, які перебувають у ВАІТ, а також при різних процедурах, які потребують седації.
Автори:
Дмитрієв Д. В., Бортник Д. І., Рудницький Ю. В., Геранін С. В., Коренчук Н. І., КНП “Вінницький обласний клінічний високоспеціалізований ендокринологічний центр”
Література:
- Maze M, Angst MS. Dexmedetomidine and Opioid Interactions: Defining the Role of Dexmedetomidine for Intensive Care Unit Se-dation. Anesthesiology [Internet]. Ovid Technologies (Wolters Klu-wer Health); 2004 nov;101(5):1059–61. Available from: http:// dx.doi.org/10.1097/00000542–200411000–00002
- Nelson LE, Lu J, Guo T, Saper CB, Franks nP, Maze M. The 2-Ad-renoceptor Agonist Dexmedetomidine Converges on an Endog-enous Sleep-promoting Pathway to Exert Its Sedative Effects. Anesthesiology [Internet]. Ovid Technologies (Wolters Kluwer Health); 2003 Feb;98(2):428–36. Available from: http://doi. org/10.1097/00000542–200302000–00024
- Venn RM, Bradshaw CJ, Spencer R, Brealey D, Caudwell E, naugh-ton C, et al. Preliminary UK experience of dexmedetomidine, a novel agent for postoperative sedation in the intensive care unit. Anaesthesia [Internet]. Wiley; 1999 Dec;54(12):1136–42. Avail-able from: http://doi.org/10.1046/j.1365–2044.1999.01114.x
- Angst MS, Ramaswamy B, Davies MF, Maze M. Comparative Analgesic and Mental Effects of Increasing Plasma Concen-trations of Dexmedetomidine and Alfentanil in Humans. An-esthesiology [Internet]. Ovid Technologies (Wolters Kluwer Health); 2004 Sep;101(3):744–52. Available from: http://doi. org/10.1097/00000542–200409000–00024
- Cortinez LI, Hsu Y-W, Sum-Ping ST, Young C, Keifer JC, Ma-cLeod D, et al. Dexmedetomidine Pharmacodynamics: Part II. Anesthesiology [Internet]. Ovid Technologies (Wolters Kluwer Health); 2004 nov;101(5):1077–83. Available from: http://doi. org/10.1097/00000542–200411000–00006
- Ebert TJ, Hall JE, Barney JA, Uhrich TD, Colinco MD. The Effects of Increasing Plasma Concentrations of Dexmedetomidine in Hu-mans. Anesthesiology [Internet]. Ovid Technologies (Wolters Klu-wer Health); 2000 Aug;93(2):382–94. Available from: http://doi. org/10.1097/00000542–200008000–00016
- Arain SR, Ruehlow RM, Uhrich TD, Ebert TJ. The Efficacy of Dex-medetomidine Versus Morphine for Postoperative Analgesia After Major Inpatient Surgery. Anesthesia & Analgesia [Internet]. Ovid Technologies (Wolters Kluwer Health); 2004 Jan;153–8. Available from: http://doi.org/10.1213/01.ane.0000093225.39866.75
- Aryan HE, Box KW, Ibrahim D, Desiraju U, Ames CP. Safety and ef-ficacy of dexmedetomidine in neurosurgical patients. Brain Injury [Internet]. Informa UK Limited; 2006 Jan;20(8):791–8. Available from: http://doi.org/10.1080/02699050600789447
- Zornow MH, Scheller MS, Sheehan PB et al. Intracranial pres-sure effects ofdexmedetomidine in rabbits. Anesth. Analg. 1992;75:232—237.
- Farag E, Argalious M, Sessler DI, et al. Use of alpha(2)-agonists in neuroanesthesia: An overview. Ochsner J. 2011;11(1):57—69.
- Huupponen E, Maksimow A, Lapinlampi P, Srkel M, Saas-tamoinen A, Snapir A, et al. Electroencephalogram spindle ac-tivity during dexmedetomidine sedation and physiological sleep. Acta Anaesthesiologica Scandinavica [Internet]. Wiley; 2008 Feb;52(2):289–94. Available from: http://doi.org/10.1111/ j.1399–6576.2007.01537.x
- Paris A, Tonner PH Dexmedetomidine in anaesthesia. Curr. Opin. Anaesthesiol 2 005;18:412—418.
- Engelhard K, Werner C, Eberspcher E, Bachl M, Blobner M, Hildt E, et al. The Effect of the 2-Agonist Dexmedetomidine and the n-Methyl-d-Aspartate Antagonist S(+)-Ketamine on the Expression of Apoptosis-Regulating Proteins After Incom-plete Cerebral Ischemia and Reperfusion in Rats. Anesthe-sia & Analgesia [Internet]. Ovid Technologies (Wolters Kluwer Health); 2003 Feb;96(2):524–31. Available from: http://doi. org/10.1213/00000539–200302000–00041
- Frlich MA, Arabshahi A, Katholi C, Prasain J, Barnes S. Hemody-namic characteristics of midazolam, propofol, and dexmedetomi-dine in healthy volunteers. Journal of Clinical Anesthesia [Inter-net]. Elsevier BV; 2011 May;23(3):218–23. Available from: http:// doi.org/10.1016/j.jclinane.2010.09.006
- Bloor BC, Ward DS, Belleville JP, Maze M. Effects of Intravenous Dexmedetomidine in Humans. Anesthesiology [Internet]. Ovid Technologies (Wolters Kluwer Health); 1992 Dec;77(6):1134–42. Available from: http://doi.org/10.1097/00000542–199212000– 00014
- Ebert TJ, Hall JE, Barney JA, et al. The effects of increasing plas-ma concentrations of dexmedetomidineinhumans. Anesthesiology 2000;93:382—394.
- E. Ramsay MA, Luterman DL. Dexmedetomidine as a Total Intrave-nous Anesthetic Agent. Anesthesiology [Internet]. Ovid Technolo-gies (Wolters Kluwer Health); 2004 Sep;101(3):787–90. Available from: http://doi.org/10.1097/00000542–200409000–00028
- Scholz J, Tonner PH Alpha2-adrenoceptor agonists in anaesthesia: a new paradigm. Curr. Opin. Anaesthesiol. 2000;13:437—442.
- Precedex (dexmedetomidine hydrochloride) injection. For intra-venous use. — Prescribing information. LakeForest, IL, USA: Hos-piraInc. 2011.
- Farag E, Argalious M, Sessler DI, et al. Use of alpha(2)-agonists in neuroanesthesia: An overview. Ochsner J. 2011; 11 (1): 57—69.
- Jakob SM. Dexmedetomidine vs Midazolam or Propofol for Seda-tion During Prolonged Mechanical Ventilation. JAMA [Internet]. American Medical Association (AMA); 2012 Mar 21;307(11):1151. Available from: http://doi.org/10.1001/jama.2012.304
- Klamt JG, de Andrade Vicente WV et al. Effects of dexmedetomi-dine-fentanyl infusion on blood pressure and heart rate during cardiac surgery in children. Anаesthesiol. Res. Pract. 2010.
- Wijeysundera Dn, naik JS, Scott Beattie W. Alpha-2 adrenergic agonists to prevent perioperative cardiovascular complications: The American Journal of Medicine [Internet]. Elsevier BV; 2003 Jun;114(9):742–52. Available from: http://doi.org/10.1016/ s0002–9343(03)00165–7
- Jaionen J, Hynynen M, Kuitunen A, Heikkila H, Perttila J, Salmen-pera M, et al. Dexmedetomidine as an Anesthetic Adjunct in Cor-onary Artery Bypass Grafting. Anesthesiology [Internet]. Ovid Technologies (Wolters Kluwer Health); 1997 Feb;86(2):331–45. Available from: http://doi.org/10.1097/00000542–199702000– 00009
- Hofer RE, Sprung J, Sarr MG, Wedel DJ. Anesthesia for a patient with morbid obesity using dexmedetomidine without narcotics. Canadi-an Journal of Anesthesia/Journal canadien d’anesthsie [Internet]. Springer Science and Business Media LLC; 2005 Feb;52(2):176– 80. Available from: http://doi.org/10.1007/bf03027725
- Abdelmalak B, Makary L, Hoban J, Doyle DJ. Dexmedetomidine as sole sedative for awake intubation in management of the crit-ical airway. Journal of Clinical Anesthesia [Internet]. Elsevier BV; 2007 Aug;19(5):370–3. Available from: http://doi.org/10.1016/j. jclinane.2006.09.006
- Koroglu A, Demirbilek S, Teksan H, Sagır O, But AK, Ersoy MO. Sedative, haemodynamic and respiratory effects of dexmedetomi-dine in children undergoing magnetic resonance imaging examina-tion: preliminary results. British Journal of Anaesthesia [Internet]. Elsevier BV; 2005 Jun;94(6):821–4. Available from: http://doi. org/10.1093/bja/aei119
- Meng Q, Xia Z, Luo T, Wu Y, Tang L, Zhao B, et al. Dexmedetomidine reduces emergence agitation after tonsillectomy in children by sevoflurane anesthesia: A case-control study. International Jour-nal of Pediatric Otorhinolaryngology [Internet]. Elsevier BV; 2012 Jul;76(7):1036–41. Available from: http://doi.org/10.1016/j. ijporl.2012.03.028
- Greenberg JW, Lancaster TS, Schuessler RB, Melby SJ. Postop-erative atrial fibrillation following cardiac surgery: a persistent complication. European Journal of Cardio-Thoracic Surgery [Inter-net]. Oxford University Press (OUP); 2017 Mar 27;52(4):665–72. Available from: http://doi.org/10.1093/ejcts/ezx039
- Almassi GH, Schowalter T, nicolosi AC, Aggarwal A, Moritz TE, Henderson WG, et al. Atrial Fibrillation After Cardiac Surgery. Annals of Surgery [Internet]. Ovid Technologies (Wolters Kluw-er Health); 1997 Oct;226(4):501–13. Available from: http://doi. org/10.1097/00000658–199710000–00011
- Liu X, Zhang K, Wang W, Xie G, Fang X. Dexmedetomidine sedation reduces atrial fibrillation after cardiac surgery compared to propo-fol: a randomized controlled trial. Critical Care [Internet]. Springer Science and Business Media LLC; 2016 Sep 21;20(1). Available from: http://doi.org/10.1186/s13054–016–1480–5
- Turan A, Bashour CA, You J, Kirkova Y, Kurz A, Sessler DI, et al. Dexmedetomidine sedation after cardiac surgery decreases atrial arrhythmias. Journal of Clinical Anesthesia [Internet]. Elsevier BV; 2014 Dec;26(8):634–42. Available from: http://doi.org/10.1016/j. jclinane.2014.05.009
- Yang Liu1, Lei Zhang2, Suozhu Wang1, Feiping Lu1, Jie Zhen1, Wei Chen. Dexmedetomidine Reduces Atrial Fibrillation After Adult Cardiac Surgery: A Meta Analysis of Randomized Controlled Trials.
- Mantz J, Josserand J, Hamada S. Dexmedetomidine: new insights. Eur J Anaesthesiol 2011;28:3–6.
- Yoshitomi T, Kohjitani A, Maeda S, Higuchi H, Shimada M, Miy-awaki T. Dexmedetomidine Enhances the Local Anesthetic Action of Lidocaine via an -2A Adrenoceptor. Anesthesia & Analge-sia [Internet]. Ovid Technologies (Wolters Kluwer Health); 2008 Jul;107(1):96–101. Available from: http://doi.org/10.1213/ ane.0b013e318176be73
- Arain SR, Ruehlow RM, Uhrich TD, Ebert TJ. The Efficacy of Dex-medetomidine Versus Morphine for Postoperative Analgesia After Major Inpatient Surgery. Anesthesia & Analgesia [Internet]. Ovid Technologies (Wolters Kluwer Health); 2004 Jan;153–8. Available from: http://doi.org/10.1213/01.ane.0000093225.39866.75
- Naaz S, Ozair E. Dexmedetomidine in current anaesthesia prac-tice-a review. Journal of clinical and diagnostic research: JCDR. 2014 Oct;8(10):GE01-GE04.
- Obayah GM, Refaie A, Aboushanab O, Ibraheem n, Abdelazees M. Addition of dexmedetomidine to bupivacaine for greater palatine nerve block prolongs postoperative analgesia after cleft palate re-pair. European Journal of Anaesthesiology [Internet]. Ovid Tech-nologies (Wolters Kluwer Health); 2010 Mar;27(3):280–4. Avail-able from: http://doi.org/10.1097/eja.0b013e3283347c15
- Anttila M, PenttilJ, Helminen A, Vuorilehto L, Scheinin H. Bio-availability of dexmedetomidine after extravascular doses in healthy subjects. British Journal of Clinical Pharmacology [Inter-net]. Wiley; 2003 Aug 29;56(6):691–3. Available from: http://doi. org/10.1046/j.1365–2125.2003.01944.x
- Cimen ZS, Hanci A, Sivrikaya GU, Kilinc LT, Erol MK. Comparison of buccal and nasal dexmedetomidine premedication for pedi-atric patients. Lerman J, editor. Pediatric Anesthesia [Internet]. Wiley; 2012 Sep 18;23(2):134–8. Available from: http://doi. org/10.1111/pan.12025
- Yuen VM, Hui TW, Irwin MG, Yuen MK. A Comparison of Intranasal Dexmedetomidine and Oral Midazolam for Premedication in Pedi-atric Anesthesia: A Double-Blinded Randomized Controlled Trial. Anesthesia & Analgesia [Internet]. Ovid Technologies (Wolters Kluwer Health); 2008 Jun;106(6):1715–21. Available from: http:// doi.org/10.1213/ane.0b013e31816c8929
- Jacobi J, Fraser GL, Coursin DB, Riker RR, Fontaine D, Wittbrodt ET, et al. Clinical practice guidelines for the sustained use of sed-atives and analgesics in the critically ill adult. Critical Care Med-icine [Internet]. Ovid Technologies (Wolters Kluwer Health); 2002 Jan;30(1):119–41. Available from: http://doi.org/10.1097/ 00003246–200201000–00020
- Riker RR. Dexmedetomidine vs Midazolam for Sedation of Critically Ill Patients<subtitle>A Randomized Trial</subtitle>. JAMA [Inter-net]. American Medical Association (AMA); 2009 Feb 4;301(5):489. Available from: http://doi.org/10.1001/jama.2009.56
- Ely EW. Delirium as a Predictor of Mortality in Mechanically Ven-tilated Patients in the Intensive Care Unit. JAMA [Internet]. Amer-ican Medical Association (AMA); 2004 Apr 14;291(14):1753. Available from: http://doi.org/10.1001/jama.291.14.1753
- Frontera JA. Delirium and sedation in the ICU. neurocrit Care 2011;14:463–74.
- Sanders RD, Maze M. Contribution of sedative-hypnotic agents to delirium via modulation of the sleep pathway. Canadian Journal of Anesthesia/Journal canadien d’anesthsie [Internet]. Springer Sci-ence and Business Media LLC; 2010 Dec 18;58(2):149–56. Avail-able from: http://doi.org/10.1007/s12630–010–9421–2
- Borbly AA, Achermann P. Ultradian dynamics of sleep after a single dose of benzodiazepine hypnotics. European Journal of Pharmacology [Internet]. Elsevier BV; 1991 Mar;195(1):11–8. Available from: http://doi.org/10.1016/0014–2999(91)90376–2
- Huupponen E, maksimow A, lapinlampi P, Srkel M, Saas-tamoinen A, Snapir A, et al. Electroencephalogram spindle ac-tivity during dexmedetomidine sedation and physiological sleep. Acta Anaesthesiologica Scandinavica [Internet]. Wiley; 2008 Feb;52(2):289–94. Available from: http://doi.org/10.1111/ j.1399–6576.2007.01537.x
- Riker RR. Dexmedetomidine vs Midazolam for Sedation of Crit-ically Ill Patients<subtitle>A Randomized Trial</subtitle>. JAMA [Internet]. American Medical Association (AMA); 2009 Feb 4;301(5):489. Available from: http://doi.org/10.1001/jama. 2009.56
- Pandharipande PP, Pun BT, Herr DL, Maze M, Girard TD, Miller RR, et al. Effect of Sedation With Dexmedetomidine vs Lorazepam on Acute Brain Dysfunction in Mechanically Ventilated Patients. JAMA [Internet]. American Medical Association (AMA); 2007 Dec 12;298(22):2644. Available from: http://doi.org/10.1001/ jama.298.22.2644.
- Soo-Bong Yu. Dexmedetomidine sedation in ICU. Korean J Anes-thesiol 2012 May;62(5):405–411






