Пропофол та Дексмедетомідин при планових процедурних седаціях – передумови для поєднання
Резюме. Процедурна седація (ПС) – це техніка введення седативних препаратів з анальгетиками чи без них для викли-кання стану, при якому пацієнт може бути толерантним до виконання неприємних процедур за збереження кардіоре-спіраторних функцій. Планові ПС проводять при різних за інвазивністю, болючістю та тривалістю процедурах, але за визначенням, вони не досягають глибини анестезії/наркозу і не потребують застосування допоміжної чи контрольованої механічної вентиляції і, тим більше, міорелаксації.
Для проведення ефективної ПС вкрай важливим є налагодження контакту з пацієнтом та його заспокоєння, в т.ч. шляхом ретельного пояснення йому деталей ПС. При виборі глибини пригнічення свідомості під час ПС прагнуть досягати компромісу між ступенем знечулення і амнезії з одного боку, та ефективністю спонтанного дихання, а також можливістю якнайшвидшого відновлення свідомості з іншого.
За можливості, проблему болю (коли свідомість частково збережена), чи ноцицептивних стимулів (коли свідомість пригнічена чи відсутня) вирішують окремо за рахунок застосування місцевого чи реґіонарного знеболення. Крім того, часто засто-совують нестероїдні протизапальні засоби (НПЗЗ) та інших препарати, що мають анальгетичні властивості, а опіоїдних анальгетиків намагаються уникати або використовують їх в малих чи мінімальних дозах.
На відміну від анестезії, навіть глибока седація не може і не повинна повністю запобігати рухам пацієнта під час інтенсивних больових/ноцицептивних стимулів. У разі необхідності, проблему рухів пацієнта вирішують не тільки і не стільки подальшим поглибленням седації, а саме за рахунок покращення знеболення і/чи фіксації пацієнта на час короткотривалих болючих маніпуляцій.
Для досягнення вказаних цілей ПС найчастіше використовують пропофол, або його комбінацію з дексмедетомідином чи мідазоламом. В цій публікації акцентується увага на перевагах застосування мультимодального підходу для тривалої ПС, що дозволяє суттєво знизити дози препаратів і частоту розвитку їх побічних ефектів, порівняно з седацією якимось одним анестетиком у суттєво вищих дозах.
Ключові слова: процедурна седація, мультимодальна аналгезія, свідомість, глибина седації, прохідність дихальних шляхів, пропофол, дексмедетомідин.
ВСТУП ТА УЗАГАЛЬНЕННЯ
З розвитком медицини, зокрема малоінвазивних хірургічних технологій та тривалих і не завжди комфортних діагностичних процедур, а також із збільшенням їх доступності для широкого кола пацієнтів, неухильно зростає потреба в забезпеченні комфорту при їх проведенні. Процедурна седація (ПС), тобто седація при планових процедурах чи болючих маніпуляціях, до цього часу недостатньо уніфікована як стосовно вибору препаратів, так і стосовно їх доз.
В різних протоколах та рекомендаціях стосовно цього існують суттєві розбіжності, що ускладнює вибір як самого протоколу, так і методу ПС в межах протоколу [1]. В Українських виданнях процедурна седація (ПС) описана не достатньо та не систематично, тому в цій публікації ми сконцентруємось на найменш висвітлених моментах і охарактеризуємо: її види, оцінку глибини пригнічення свідомості, а також базові принципи її проведення.
Деталізації потребують такі принципово важливі моменти при проведенні ПС як вибір методу підтримки прохідності дихальних шляхів (ДШ) та оксигенації залежно від глибини пригнічення свідомості. Для підвищення безпеки пацієнта важливими аспектами є характеристика нереспіраторних небажаних явищ та ускладнень, які виникають як під дією анестетиків, так і в результаті недостатнього знеболення та седації.
В цій публікації ми також зупинимось на методах профілактики та лікування найбільш частих ускладнень під час ПС. В наступних публікаціях ми плануємо висвітити принципи вибору препаратів та їх доз, а також особливості безпечного та ефективного застосування ПС при різних процедурах в різних галузях медицини.
ЗАГАЛЬНІ ПРИНЦИПИ ПРОВЕДЕННЯ ПС
Термінологічні аспекти. До того, як кілька років тому був введений термін «процедурна седація» широко використовувався термін conscious sedation, тобто седація в свідомості, який підкреслював її відмінності від глибокої седації та анестезії. За визначенням Європейської Асоціації Анестезіології (ESA) процедурна седація (ПС) і анальгезія – це введення седативних препаратів з анальгетиками або без них, з метою покращення комфорту пацієнта та полегшення виконання процедури при планових або невідкладних процедурах як для госпіталізованих, так для амбулаторних пацієнтів, як в операційній, так і поза нею [2].
Це ж керівництво (гайдлайн) вказує на те, що ПС вважається «адекватною», коли зберігається контроль дихальних шляхів (ДШ) і спонтанне дихання, незважаючи на пригнічення рівня свідомості.
В гайдлайні Американської асоціації невідкладної медицини у самому визначенні ПС вже зазначається про адекватність серцево-судинної та дихальної функції під час седації. ПС – це техніка введення седативних чи дисоціативних засобів з анальгетиками чи без них для викликання стану, при якому пацієнт може бути толерантним до неприємних процедур за підтримання кардіореспіраторних функцій [3]. Проте в цьому визначенні згадуються дисоціативні засоби такі, як кетамін, застосування якого перспективне саме для невідкладної медицини і у дітей, а при планових ПС у дорослих його використовують рідко.
Покази до ПС. Загалом серед показів до ПС є дві основні групи:
- пов’язані з пацієнтом – надмірна збудженість, не схильність до співпраці (кооперації) під час процедури, низький поріг толерантності до болю;
- пов’язані з процедурою – болючі маніпуляції та втручання, що вимагають мінімального обсягу руху пацієнта або певного рівня розслаблення м’язів.
Види ПС. Принципово можна виділити ургентні ПС – ті, що проводять пацієнтам в комплексі заходів невідкладної допомоги (седація при невідкладних маніпуляціях), а також планові ПС, де пацієнт готується до планового втручання. За глибиною седацію найчастіше розділяють дихотомічно на поверхневу та глибоку, або більш точно на 4 рівні: 1) мінімальна седація (анксіолізіс), 2) помірна седація/анальгезія, 3) глибока седація/анальгезія і, окремо, 4) загальна анестезія (див. нижче).
Хто може та повинен виконувати ПС? В розвинених країнах кількість ПС наростає з року в рік, і на сьогодні значно перевищує цей показник в Україні та країнах, що розвиваються. Тому до їх виконання залучаються не тільки лікарі анестезіо-логи, але й інші спеціалісти, які пройшли відповідні курси, тренінги та мають сертифікати, що дозволяють їм виконання ПС.
Виходячи з цього, в закордонних гайдлайнах ПС іноді розділяють на ті, які виконують анестезіологи чи сертифіковані медсестри-анестезисти (CRNA), і вони можуть бути будь-якої глибини та складності в забезпеченні прохідності дихальних шляхів (ДШ), і ті, що виконують інші спеціалісти. До спеціалістів, які можуть виконувати ПС при болючих процедурах, найчастіше належать: лікарі невідкладної допомоги, стоматологи, гастроентерологи, ортопеди-травматологи, подологи та ін. При виконанні ПС не анестезіологами вона має бути лише мінімальної (анксіолізис) чи помірної глибини і не потребувати застосування складних методів забезпечення прохідності ДШ.
Згідно гайдлайнів, не анестезіологи можуть виконувати ПС лише пацієнтам без супутніх захворювань (ASA I), або таким, що мають не більше одного супутнього захворювання, і таке захворювання не повинно спричиняти функціональних обмежень (ASA II). Пацієнтам з супутніми захворюваннями, що спричиняють функціональні обмеження (ASA IІI), ПС повинні виконувати лише анестезіологи, а місце виконання – процедурний кабінет чи операційна – повинно визначатися з урахуванням тривалості процедури та інших факторів ризику.
В Україні спеціальних тренінгів по ПС не існує (тим більше для не анестезіологів), а доступ до седативних засобів різко обмежений, тому ПС поки що проводять виключно анестезіологи. Більше того, при проведенні глибокої ПС анестезіологу повинна допомагати медсестра-анестезист.
Відмінності між ургентними та плановими ПС. При анестезіологічному забезпеченні ургентних/невідкладних маніпуляцій (як методом наркозу так і седації) нерідко дуже складно чи неможливо одночасно поєднати безпеку та комфорт пацієнта. В таких ситуаціях пріоритет, безумовно, надають саме безпеці, і на цьому наголошується в численних стандартизованих алгоритмах надання невідкладної допомоги.
Оскільки невідкладні процедури дуже різноманітні, а діагнози та стан пацієнтів, яким вони призначаються, теж можуть сильно відрізнятися, то і методи їх анестезіологічного забезпечення, як в навчальній, так і в науковій літературі найчастіше детально наводяться за нозологічним принципом [4]. Описані також відмінності та особливості вибору препаратів для анальго-седації, а також засобів моніторингу для лікарень з високим оснащенням, в противагу погано оснащеним лікарям в країнах, що розвиваються [5].
Спільним для ПС ургентних хворих є більш широке використання препаратів з мінімальним впливом на гемодинаміку, таких, як кетамін, часто в поєднанні з бензодіазепінами. Крім того, перевагу нерідко надають препаратам меншої вартості, таким як тіопентал натрію і знову ж таки кетамін та діазепам, незважаючи на те, що вони мають властивості подовженої седації після виконання процедур.
Під час проведення планових ПС завжди прагнуть одночасно досягнути і комфорту па-цієнта і належного рівня його безпеки. Цьому сприяють стабільний стан пацієнта, і можливість застосування в місцях, де проводять планові ПС сучасних засобів для седації (таких як пропофол та дексмедетомідин), моніторингу, а також оксигенації. Тому за оснащенням засобами для проведення моніторингу та оксигенації місця проведення планових ПС повинні відповідати сучасним вимогам і наближатися до тих, що є в операційних.
На відміну від ургентних випадків, при проведенні ПС у планових пацієнтів різко обмежують використання препаратів з дисфоричними ефектами, таких як кетамін, або тих, що мають ефекти подовженої седації, таких як діазепам.
Відмінності між ПС з наступним плановими швидким пробудженням та ПС з плановою подовженою седацією. Сучасні принципи швидкоїреабілітації диктують необхідність раннього пробудження, ранньої активації та вертикалізації переважної більшості хворих, яким проводять планову ПС. У таких випадках перевагу надають препаратам з короткими слідовими реакціями, такими, як пропофол. Разом з тим, при тривалих процедурах на етапі їх початку і в першій половині додатково до пропофолу прагнуть створити стабільний седа-тивний фон. Цей фон може бути помірного чи середнього ступеню глибини за рахунок застосування препаратів з середнім періодом напіввиведення, таких, як мідазолам чи дексмедетомідин.
В противагу цьому існують деякі процедури, які потребують подовженої седації, жорсткого контролю АТ (запобігання артеріальній гіпертензії) та утримання пацієнтів в горизонтальномуположенні певний час після їх виконання. Такими процедурами бувають, наприклад, ендоваскулярні втручання (особливо на артеріях голови, шиї, коронарних артеріях).
У таких випадках для проведення ПС основними можуть бути препарати з середнім періодом напіввиведення, такі як мідазолам чи дексмедетомідин. Ці препарати можуть вже забезпечувати тривалу та стабільну середню чи глибоку седацію, а на момент найбільш інтенсивних маніпуляцій додатково може бути застосований пропофол в помірних дозах, який короткочасно забезпечить найбільш глибоку седацію чи навіть анестезію.
Таким чином, за однакової глибини седації основні відмінності між швидким та повним пробудженням з одного боку, і плавним та поступовим з іншого, полягає в співвідношенні доз пропофолу з однієї сторони та мідазоламу чи дексмедетомідину з іншої, які доповнюють седацію пропофолом.
ГЛИБИНА ПРИГНІЧЕННЯ СВІДОМОСТІ ПРИ ПС ТА СТУПІНЬ ПРИГНІЧЕННЯ РУХОВОЇ АКТИВНОСТІ
Характеристики рівнів глибини седації. Оцінка глибини тривалої седації найбільш ретельно розроблена та стандартизована у пацієнтів, що перебувають на лікуванні у відділенні інтенсивній терапії (ВІТ) та потребують адаптації до ШВЛ. У ВІТ седації в основному підлягають пацієнти, що мають той чи інший ступінь психомоторного збудження. Так, для оцінки ефективності седації у ВІТ найбільшого розповсюдження набули дві шкали – Ramsey та RASS (Richmond Agitation Sedation Scale), які якраз і включать стан пацієнта від вираженого психомоторного збудження з одного боку до глибокої седації з іншого.
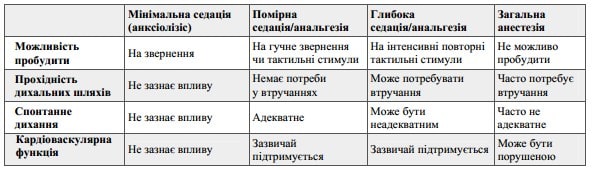
Шкала Ramsey, що включає 6 стадій простіша і зручніша, в той час, як шкала RASS більш громіздка (включає аж 10 стадій), проте суттєво точніша та інформативніша [6]. Разом з тим, при процедурних седаціях, необхідності реєструвати збудження та ажитацію немає, тому використовують інші критерії і відразу слід підкреслити, що чіткого та загально визнаного підходу до рівня оцінки пригнічення свідомості при ПС не існує. На сьогодні найпопулярнішою є шкала седації Американської Асоціації Анестезіологів (АSA), яка включає всього 4 стадії: мінімальну, помірну та глибоку седацію, а також загальну анестезію (таб. 1).
Таблиця 1. Класифікація седації Американської Асоціації Анестезіологів (АSA) [7].
Анксіолізис чи мінімальна седація. Характеристика мінімальної седації чи анксиолізису полягає в збереженні свідомості, але зміні настрою – заспокоєнні. Анксиолізис легше і стабільніше досягається з використанням помірних доз препаратів з середнім періодом напіввиведення, таких як дексмедетомідин та мідазолам. При титрації пропофолу теж можна досягнути анксіолізису, але у зв’язку з коротким періодом напіввиведення, а також різною індивідуальною відповіддю на одну і ту ж його концентрацію, цей стан не стабільний і може або зникати, або переходити вже в помірну чи навіть глибоку седацію.
Слід наголосити, що анксіолізис не слід проводити при болючих процедурах. У таких випадках спочатку слід забезпечити ефективне місцеве чи реґіонарне знеболення, або вирішити проблему аналгезії у інший спосіб, а потім вже вирішувати питання про необхідний/безпечний рівень седації.
Помірна седація, дрімота, поверхневий сон. На відміну від анксіолізису, при помірній седації свідомість вже медикаментозно пригнічується. Вона може бути охарактеризована як медикаментозне запаморочення, приглушення, дрімота, але пацієнта можна повторним голосним звертанням до нього і легко пробудити. Дрімота є якраз однією з характеристик терміну «седація в свідомості», який широко використовувався в минулому.
Стану помірної седації чи «седації в свідомості», чи дрімоти теж легше досягати з використанням дексмедетомідину та мідазоламу, але це вже цілком можливо і з використанням інфузії пропофолу (ліпше, коли використовують шприцевий насос). Поверхневий медикаментозний сон частіше відносять до помірної седації, хоча іноді вже і до глибокої. Характерно, що не існує як чіткої межі між поверхневим та глибоким сном так і між помірною та глибокою седацією.
Комбінація пропофолу з дексмедетомідином, мідазоламом та іншими препаратами з седативним ефектом робить стан седації чи медикаментозного сну стабільнішими. Хоча під час процедури пацієнти не втрачають свідомості, проте вони можуть пам’ятати далеко не всі її моменти, тобто у них виникає часткова амнезія. Помірну седацію, як і анксіолізис доцільно проводити при не болючих процедурах або на фоні ефективного знеболення.
Глибока седація, медикаментозний сон. Характеристикою глибокої седації (глибокого медикаментозного сну) є відсутність свідомості при відсутності дії больових/ноцицептивних стимулів і пробудження, коли вони з’являються, що диктує необхідність ефективного знеболення. Пробудити пацієнта навіть повторним голосним звертанням до нього вже складно, чи неможливо.
Для пацієнтів, що потребують ПС і мають обмежені знання в медицині, сон чи глибокий сон звучить зрозуміліше і краще, ніж седація, бо деякі з них бояться залишатися в свідомості, і краще, ніж наркоз, тому що наркоз асоціюється з певною непередбачуваністю та ризиками. Тому при розмові з багатьма пацієнтами ліпше не тільки вживати цей термін, але й переконати їх, що саме цей рівень медикаментозного пригнічення свідомості є для них оптимальним.
Пацієнту слід пояснити, що так як здорова людина може раптово прокинутися від глибокого сну, так і під час глибокої седації сильний подразник може призвести до інтенсивних рухів з частковим пробудженням. На побоювання щодо прокидання їм слід пояснити, що прокидання буде частковим, болю вони майже не будуть відчувати і, якщо навіть будуть, то цей біль буде їх мало турбувати. Крім того, за даними цілого ряду досліджень встановлено, що епізоди рухової активності і часткового просинання більшість пацієнтів, що перебувають в глибокій седації, не пам’ятають.
Різке пробудження найбільш характерне при проведенні моноседації пропофолом [8]. Відсутність спогадів (амнезія) про епізоди просинання частіше спостерігається у разі глибокої мультимодальної седації (наприклад з дексмедетомідином чи мідазоламом), ніж при моноседації пропофолом.
Моніторована анестезіологічна допомога (Monitored anesthesia care). В США широкого розповсюдження набула практика, коли анксіолізис та помірну седацію проводять не анестезіологи чи сертифіковані медсестри-анестезисти (CRNA), а лікарі, які виконують самі процедури. В той же час глибоку седацію проводять виключно анестезіологи, інтенсивісти чи сертифіковані медсестри-анестезисти. Для того, щоб підкреслити потенційно вищі якість та безпеку проведення процедур з седацією (найчастіше глибокою) у виконанні анестезіологів на початку цього століття був введений термін «моніторована анестезіологічна допомога» (Monitored anesthesia care – МАС) [9].
В інших країнах цей термін не набув широкого розповсюдження, а його еквівалентом якраз і є глибока ПС. Слід пам’ятати, що коли під час болючих процедур/маніпуляцій пацієнт зовсім не прокидається, то це вже не глибока медикаментозна седація і не моніторована анестезіологічна допомога, а загальна анестезія (www.uptodate.com/contents/monitored-anesthesia-care-in-adults). Відповідно, і ризики анестезії, яку проводять на самостійному диханні без встановлення надійного контролю ДШ вищі, ніж при глибокій седації.
Загальна анестезія, наркоз. Відмінності загальної анестезії від глибокого медикаментозного сну в основному полягають в неможливості різкого пробудження під час анестезії та більш поступовому відновленні повноти/адекватності свідомості після пробудження від анестезії.
Загальну анестезію теж розділяють на поверхневу, середньої глибини та глибоку. При поверхневій анестезії все ще можуть зберігатися рухипацієнта у відповідь на інтенсивну ноцицептивну стимуляцію. Повне зникнення рухів пацієнта у відповідь на розріз шкіри досягається лише при середній глибині наркозу.
Вже під час поверхневої анестезії, як правило, відбувається дискоординація м’язів, що підтримують прохідність верхніх ДШ, що супроводжуєтьсязападінням кореня язика. Такі порушення прохід-ності верхніх ДШ вимагають проведення маневру виведення нижньої щелепи або використання орочи назофарингельного повітроводу, а також інгаляції кисню, навіть якщо стадія наркозу виникла на короткий період. Крім того, під час поверхневої анестезії знижується і частота та глибина дихання, але гемодинаміка все ще може залишатися стабільною. Під час середньої глибини анестезії диханнястає вже поверхневим та неефективним, тому пацієнту вже необхідно проводити ШВЛ.
Глибока анестезія супроводжується пригніченням дихання та зниженням АТ. Ця тема детально описана в підручниках з анестезіології, тому в цій роботі нами не розглядається.
Больові та ноцицептивні подразники. За оновленим визначенням Міжнародної Асоціації Дослідження Болю (IASP, www.iasp-pain. org/PublicationsNews/NewsDetail.aspx?ItemNumber= 10475), біль – це неприємне відчуття та емоційне переживання, пов’язане з реальним або ймовірним ушкодженням тканин. Слід підкреслити, що неприємність відчуття та емоційне переживання пов’язані з інтенсивними подразниками, які властиві для болю, можливі лише за збереження свідомості.
За відсутності свідомості (наприклад, під час анестезії) ці ж подразники, які викликають підвищення тиску, тахікардію і підвищення викиду гормонів стресу вже не вважають больовими, а називають ноцицептивними. Оскільки під час глибокої седації складно визначити, чи у пацієнта збережена свідомість, то сурогатним критерієм свідомості іноді вважають спогади подій під час операцій/процедур. Отже, якщо після ПС спогадів не було, то інтрапроцедурні реакції вже не вважають больовими, але ноцицептивними.
Різні анестетики по різному пригнічують відповідь пацієнта на больові чи ноцицептивні стимули. Наприклад, пропофол більше пригнічує свідомість і переводить больовий стимул в ноцицептивний в той час, як дексмедетомідин менше пригнічує свідомість, але суттєво зменшує інтенсивність больових відчуттів. Окрім анальгетичного ефекту, дексмедетомідину властивий також і ефект зниження негативного емоційного забарвлення больових відчуттів.
Іншими словами навіть за збереження свідомості препарат може певною мірою переводити больові відчуття в ноцицептивні. Тіопентал натрію за цими ефектами дуже схожий на пропофол, оскільки обидва препарати є агоністами тих же підтипів ГАМК рецепторів. Бензодіазепіни теж діють через інші підтипи ГАМК рецепторів і мідазолам менше, ніж пропофол та тіопентал, пригнічує свідомість і певною мірою може сприяти поліпшенню сприйняття болю за збереженої свідомості.
Анальгоседація та седоанальгезія та їх відмінності від ПС. Під терміном анальгоседація найчастіше розуміють проведення седації з додаванням наркотичних анальгетиків у ВІТ для зменшення психомоторного збудження та адаптації до проведення ШВЛ [10]. Окрім ефекту знеболення, наркотичні анальгетики добре пригнічують респіраторний драйв, тому їх і застосовують для адаптації до ШВЛ.
За даними переважної більшості досліджень застосування наркотичних анальгетиків у комбінації з більшістю в/венних анестетиків дозозалежно підвищує частоту депресії дихання і для пацієнтів, яким проводять респіраторну підтримку це, безумовно, позитивний ефект. Оскільки при ПС не проводять ШВЛ, то пригнічення самостійного дихання вкрай не бажане, тому і використання наркотичних анальгетиків у більшості випадків не доцільне, особливо у разі проведення ефективної місцевої чи регіонарної анестезії. Коли ж проведення ефективної місцевої чи регіонарної анестезії не можливе, то для знеболення слід застосовувати засоби з мінімальним впливом на респіраторний драйв.
Якщо ж процедури вкрай болючі і без наркотичних анальгетиків адекватного знеболення досягнути складно, то їх слід використовувати в мінімальних дозах. У разі необхідності підтримки анальгетичного компоненту, зниження дози наркотичних анальгетиків може з успіхом компенсуватися анестетиками, що мають аналгетичний компонент, такими як дексмедетомідин, а в певних випадках і кетамін. Таким чином підходи до використання наркотичних анальгетиків в рамках ПС поза межами операційної складні та комплексні і суттєво відрізняються від анальгоседації у ВІТ, тому будуть детальніше описані в наступних публікаціях.
Рухова активність під час седації. Якщо під час седації пацієнту завдають сильної больової/ ноцицептивної стимуляції, наприклад, проводять хірургічний розріз шкіри, то природньою реакцією є рухова активність пацієнта. Слід підкреслити, що навіть глибока седація, на відміну від анестезії не може, і не повинна повністю запобігати рухам пацієнта під час маніпуляцій.
Для кращого розуміння співвідношення глибини глибокої седації та анестезії з припиненням рухової активності на больові/ноцицептивні подразники наведемо приклад з термінології визначення потужності інгаляційних анестетиків. Так, ключовим кількісним показником для оцінки потужності інгаляційних анестетиків є мінімальна альвеолярна концентрація (МАК), при якій у відповідь на розріз шкіри у половини пацієнтів виникають мимовільні рухи, а у половини вони відсутні.
Варто зазначити, що при концентрації в 1 МАК близько 95% пацієнтів перебувають без свідомості і 99% не пам’ятають факту розрізу, болю та рухів у відповідь на розріз. Іншими словами, при концентрації інгаляційного анестетика в 1 МАК у 50 пацієнтів із 100 на інтенсивний ноцицептивий стимул будуть рухи, але лише у 5 буде біль, і лише у 1 буде пам’ять про цей біль. Рухи пацієнтів, що перебувають в анестезії нецілеспрямовані та слабкі і за своєю силою в кілька разів слабші, ніж ті рухи, коли пацієнт в свідомості і легко попереджаються фіксацією рук до операційного столу (найчастіше його бокових підтримувачів для рук).
Виходячи з цього, в більшості випадків інгаляційну анестезію проводять з концентрацією севофлюрану в 0,8-1 МАК (щоправда, часто з додаванням седативного компоненту якимось з в/венних анестетиків чи ад’ювантів), а рухи пацієнта під час основного етапу операції унеможливлюються внаслідок підтримання міорелаксації, а також фіксації пацієнта.
При використанні потужних в/венних анестетиків, таких, як пропофол чи тіопентал натрію, теж нерідко застосовують поняття концентрації в крові чи дози на 1 кг маси тіла, при якій у відповідь на інтенсивний ноцицептивий стимул у половини пацієнтів будуть виникати рухи в кінцівках. Щоправда цей термін для в/венних анестетиків так і не набув широкого вжитку. При рівні глибини в/венної анестезії, коли у відповідь на розріз у половини пацієнтів будуть виникати рухи в кінцівках, переважна більшість пацієнтів теж ані про біль, ані про рухи пам’ятати не буде.
Тому ще раз наголошуємо, що хоча короткочасні слабкі рухи пацієнтів, і не бажані під час наркозу, але вони цілком допустимі при адекватній і якісній ПС. Безумовно, що коли такі рухи виникають, то седацію поглиблюють, але для того, щоб такі рухи не заважали виконанню процедур на період поки подіють анестетики, руки пацієнта фіксують так, як під час хірургічних операцій. Досвідчені в ПС анестезіологи та анестезитки під час найбільш болючих/інтенсивних процедурних стимуляцій нерідко короткочасно утримують пацієнтів.
Кооперація анестезіолога та спеціаліста, який проводить процедури. Ретельне пояснення спеціалісту, який проводить процедури, що рухи пацієнта під час найбільш інтенсивних маніпуляцій у більшості випадків не є ознакою його повного пробудження, і такі рухи цілком можливі під час ПС, дозволяє уникнути проведення занадто глибоких седацій чи анестезій. Якщо спеціаліст, який проводить процедури, буде завчасно (хоча б за хвилину) інформувати анестезіолога про найбільш болючі маніпуляції, які плануються, то це дозволить цілеспрямовано вводити додаткові болюсні дози анестетика.
Таке введення на упередження призводить до синхронізації інтенсивної ноцицептивної стимуляції з короткочасним поглибленням седації до рівня анестезії та мінімаізації серцево-судинних реакцій, рухових реакцій пацієнта з одного боку та занадто глибокого пригнічення дихання з іншого. В результаті такої командної роботи підвищується ефективність знеболення/седації та умови роботи хірурга чи іншого спеціаліста, хто виконує процедури.
ПЕРЕДОПЕРАЦІЙНЕ ОБСТЕЖЕННЯ ТА ІНФОРМОВАНА ЗГОДА
Передопераційне обстеження. У більшості випадків, передопераційний огляд та обстеження включає збір анамнезу, лабораторні дослідження, здійснюються за правилами, що регламентують ці процедури перед проведенням загальної чи реґіонарної анестезії. Ретельний збір анамнезу та об’єктивне дослідження напередодні ПС визначають фізикальний та функціональний стан пацієнта і диктують необхідність проведення лабораторних чи функціональних досліджень та їх перелік.
Крім того, слід завчасно пояснити пацієнту основні деталі ПС та попередити про необхідність утримання від їжі (див. нижче). Якщо анестезіолог бачить пацієнта вже в день ПС, то він повинен оцінити безпечність її проведення в цей день і, у разі наявності факторів ризику, оцінити та обговорити з пацієнтом та колегами потенційну користь відкладення ПС до отримання результатів додаткових обстежень.
Ключові пункти, які слід оцінити під час передопераційного обстеження:
• чи були проблеми при проведенні попередніх ПС, наркозів, реґіонарної анестезії чи перебуванні у ВІТ? Якщо так, то які?
• порушення функції органів та систем та визначити функціональний клас за шкалою американської асоціації анестезіологів (ASA);
• ожиріння, синдром сонного апное;
• анатомічні проблеми, які обумовлюють«тяжкі дихальні шляхи»;
• фактори ризику з боку дихальної системи;
• анамнез паління;
• фактори ризику з боку серцево-судинної системи;
• наявність алергій;
• перебіг попередніх анестезій чи ПС;
• чутливість до анестетиків, толерантність до алкоголю;
• толерантність до болю та анамнез щодо прийому препаратів для знеболення та седації, а також їх ефективності;
• психоемоційний стан та врівноваженість,спроможність до кооперації;
• медикаменти, які приймає пацієнт;
• інші аспекти, які можуть впливати на перебіг седації.
Якщо в результаті обстеження встановлюють, що у пацієнта І-ІІ функціональний клас за шкалою ASA, то це свідчить про потенційно низькі ризики ПС (за дотримання всіх вимог до її виконання). Уразі виявлення ASA ІІІ-ІV, ці ризики значно вищі іу таких випадках рішення про проведення ПС чи її відміну/відкладення, а також про місце її проведення, обладнання тощо повинно бути обговореним та узгодженим з усіма зацікавленими сторонами.
Утримання від прийому їжі та води є вагомим фактором зниження ризику розвитку нудоти та блювоти, а також аспірації шлункового вміступід час ПС. Разом з тим загальновизнаних та науково-обґрунтованих рекомендацій рамок щодо часу передопераційного голодування до ПС не існує [11]. Вважають, що утримання від твердої їжі протягом 4 год і від вживання прозорої рідини протягом 2 год може бути цілком достатнім у осіб, в яких відсутні фактори ризику аспірації.
Це означає, що такі особи можуть вживати лише незначну чи помірну кількість твердої їжі, яка гарно засвоюється (краще ту, що містить складні вуглеводи), та незначну чи помірну кількість рідини (негазованої води, чаю чи розчинів вуглеводів, таких як мальтодекстрин). У осіб з факторами ризику затримки евакуації шлункового вмісту, або з анамнезом нудоти та блювоти, період передопераційного голодування повинен бути подовженим. М’ясо, жирну, жарену та іншу їжу, яка може перетравлюватися довше або призводити до здуття живота, не слід вживати мінімум 8 год. до ПС [12].
Інформація для пацієнта про ПС та отримання інформованої згоди. Ретельне поясненняпацієнту як самих маніпуляцій так і дій анестезіолога під час ПС є не менш важливим, ніж ті пояснення, які роблять перед наркозом, а подекуди навіть значно важливішими. Пацієнту слід також детально пояснити можливі ризики, шляхи їх змен-шення, а також можливі альтернативи проведенню ПС. В більшості випадків усвідомлення пацієнтом того факту, що ризики часто збільшуються зі збільшенням глибини седації чи медикаментозного сну дозволяє узгодити цільовий рівень седації в противагу початковому бажанню пацієнта «за будь-яких умов нічого не відчувати і не прокидатися».
Слід переконати пацієнта, що короткочасне прокидання не тільки можливе, але в деяких випадках і доцільне для виконання кооперації з лікарями, що проводять процедуру, чи анестезіологом і таке прокидання може супроводжуватися його мимовільними рухами. У разі отримання інформованої згоди саме на седацію з можливістю часткового та короткочасного прокидання пацієнт значно спокійнішесприймає таке прокидання і менше рухає кінцівками. Розуміння короткочасності та безпечності прокидання суттєво зменшує його незадоволення від ПС при виникненні подібних епізодів, якщо вони навіть запам’ятовуються ним.
В деяких галузях медицини вже міцно склалася практика, коли основні деталі процедур, що виконуються, їх потенційні укладення і навіть ПС з їїможливими ускладненнями прописані в формі інформованої згоди пацієнта. У таких випадках слід переконатися, що пацієнт з цією формою ознайомився і усвідомив її ключові моменти, та отримаввідповіді на свої запитання. Варто підкреслити,що інформована згода – це не тільки підписання її форми, а вона повинна бути радше процесом безперервної комунікації з пацієнтом та його родичами чи законними представниками.
ПРОТИПОКАЗИ ДО ПРОВЕДЕННЯ ПС, ТА УМОВИ ЇЇ ПРОВЕДЕННЯ У РАЗІ ВІДНОСНИХ ПРОТИПОКАЗІВ
Загальні підходи щодо протипоказів. Чітко визначених протипоказів до ПС, так само як і до загальної анестезії не існує, тому рішення про необхідність та безпечність проведення самої процедури та ПС повинні прийматися і узгоджуватися між лікарями та з пацієтом на основі даних передопераційного обстеження. Протипокази повинні розглядатися не тільки в аспекті «проводити ПС чи ні», але й в аспекті чи можна проводити ПС у звичайному місці зі звичайним обладнанням, чи необхідно застосувати повноцінно обладнану операційну. Залежно від того, яких ускладнень можна очікувати, протипокази можна розділити на декілька груп:
• порушення прохідності верхніх ДШ та функції зовнішнього дихання;
• аспірація шлункового вмісту;
• порушення функції ССС;
• порушення метаболізму та виведення препаратів;
Анестезіолог повинен оцінити можливі ризики небажаних явищ (в т.ч. серйозних) та ускладнень (див. нижче наприкінці цієї публікації) та чітко донести цю інформацію до колег, які планують виконання процедур, а також пацієнта та їх родичів, і чітко задокументувати це. Якщо процедура планова і її відкладення не пов’язано з ризиками для пацієнта чи окремих його органів та систем, а ризики седації вкрай високі, то анестезіолог повинен викласти ці ризики та своє бачення плану підготовки пацієнта до ПС. Ця підготовка зазвичай включає можливі консультації суміжних спеціалістів, певні методи лікування пацієнта, а також прегабілітації (тренувальних процедур, які підвищують функціональний стан пацієнта).
У разі, коли спеціаліст, який планує процедуру, та пацієнт наполягають на проведенні процедури, слід розглянути можливістьпроведення седації, а можливо реґіонарного знеболення чи наркозу в умовах операційної, яка гарно оснащена обладнанням для моніторингу, а також анестезіологічним та реанімаційним обладнанням. Тобто можна стверджувати, що певні протипокази можуть бути відносними – в умовах процедурного кабінету тяжкого пацієнта на ПС брати не слід, втой же час в гарно оснащеній операційній цьомуж пацієнту ПС може бути проведена значно безпечніше.
В противагу плановим, затримка з проведенням деяких ургентних процедур може нести в собі ризики для життя та здоров’я пацієнта чи для окремих органів та систем, тому ризики седації повинні бути співставленні з ризиками відкладення процедур.
Протипокази до глибокої ПС, пов’язані з ризиками обструкції ДШ та гіпоксемії. До факторів ризику виникнення клінічно значимої гіпоксемії можна віднести підвищену чутливість до анестетиків (наприклад, синдром сонного апное, міастенія в стадії загострення), клінічно-значиму гіпоксемію та гіперкапнію в спокої (наприклад на фоні загострення ХОЗЛ чи після перенесеного тяжкого перебігу COVID-19), надмірне ожиріння, та всі види порушень прохідності ДШ (особливо верхніх).
У таких випадках слід розглянути можливість виконання ПС в операційних чи кабінетах ПС, які оснащені якісним обладнанням для інтубації та респіраторної підтримки. У випадку необхідності проведення глибокої седації пацієнтам з предикторами тяжких ДШ окрім використання додаткового обладнання, слід розглянути можливість залучення ще одного досвідченого спеціаліста в забезпеченні прохідності ДШ (анестезіолога, брохноскопіста).
Протипокази, пов’язані з ризиком аспірації. До таких можна віднести повний шлунок чи потенційно повний шлунок (коли невідомо чи пацієнт утримувався від їжі достатній час), вагітність, гастрити. У таких випадках слід розглянути можливість відкладення ПС до спорожнення шлунку, тобто на 6-8 год. від моменту останнього прийому їжі. Крім того слід забезпечити доступ до потужного аспіратора і додатково перевірити його готовність на момент початку седації.
Крім того, варто розглянути можливість проведення процедури та ПС в положенні, яке запобігає розвитку пасивної регургітації (наприклад, з піднятим головним кінцем), або в положенні, яке запобігає аспірації шлункового вмісту в трахею (положення на животі, опущений головний кінець). У випадку необхідності седації ургентних/невідкладних процедур ризики аспірації слід співставляти з ризиками затримки процедур. Зазвичай ПС у таких пацієнтів безпечніше проводити в умовах добре оснащеної операційної.
Протипокази, пов’язані з серцево-судинними ризиками. Узагальненим протипоказом до ПС може бути тяжкий перебіг або декомпенсація будь-якого захворювання серцево-судинної системи (ССС). У свою чергу зрив компенсації функцій ССС можна розділити на:
• приступ артеріальної гіпертензії та гіпертонічний криз;
• депресію міокарда та загострення серцевої недостатності;
• стійке зниження АТ внаслідок гіповолемії чи вазодилятації;
• зрив серцевого ритму.
Для оцінки можливості безпечного проведення ПС при субкомпенсації захворювань ССС часто необхідне більш ретельне фізікальне обстеження, обстеження пацієнта іншими методами (ЕКГ, УЗД серця, лабораторні аналізи). У разі позитивного рішення на ПС необхідне посилення моніторин-гу під час проведення процедур, так і в ранньомупісляпроцедурному періоді, а також наявність і готовність до використання додаткових медикаментів для підтримки функції ССС (вазопресори, вазодилятатори, інотропи, атропін, антиаритмічні засоби).
У пацієнтів з високим ризиком як гіпо так і гіпертезії доцільний моніторинг АТ в автоматичному режимі. У пацієнтів з високим ризиком розвитку аритмій під час ПС доцільний ЕКГ-моніторинг. Венозний доступ та кардіореспіраторний моніторинг у таких пацієнтів теж повинен залишатися довше, до повного виходу с седації і зниження ризиків з боку ССС.
Miastenia Gravis в стадії загострення. Протипоказом для ПС є діагноз загострення міастенії. Деякі протипокази можуть розповсюджуватися не на ПС в цілому, а на окремі препарати. Так, наприклад, при міастенії гравіс бензодіазепіни входять в список препаратів, які вживати не бажано, а дексамедетомідин є цілком безпечним.
Інші протипокази. Серед інших протипоказів варто виділити неможливість кооперації з пацієнтом, старечий вік за наявності функціональних порушень, захворювання печінки та нирок тяжкого ступеню, що впливають на метаболізм основних анестетиків для ПС.
ПРЕМЕДИКАЦІЯ, ВЕНОЗНИЙ ДОСТУП, ФІКСАЦІЯ ПАЦІЄНТА
Чи необхідна премедикація? Незважаючи настійке переконання щодо необхідності премедикації, яке склалося у лікарів старшого покоління, сучасні підходи полягають в істотному її обмеженні. Натомість, замість введення фармакологічнихпрепаратів, суттєво більшої уваги приділяють ретельному поясненню деталей виконання процедур, а також детально роз’яснюють суть седації, і особливо седації з частковим збереженням свідомості.
Це дозволяє значно краще заспокоїти пацієнта івсилити йому впевненість в позитивному результаті, тим самим створити позитивний емоційнийфон. У разі, коли пацієнт все ж таки нервує, седативні вводять вже не заздалегідь, а ближче до виконання процедур і радше в індивідуалізованих дозах, ніж однакових для всіх, як то часто було кількадесятиліть тому.
Обмеження внутрішньом’язевого введення. Раніше для зменшення страху пацієнта з метоюпремедикації часто в/м’язево застосовували наркотичний анальгетик, атропін, димедрол, діазепам таін. В той же час, ефекти від в/м’язевого введеннябули мало прогнозовані і не завжди бажані. Так, наприклад, дітям в/м’язево часто вводили кетамін, а оскільки він підвищує салівацію, його введеннячасто поєднували з в/м’язевим введенням атропіну.
Разом з тим, швидкість настання ефекту відв/м’язевого введення кетаміну (кілька хвилин) значно вища, ніж швидкість настання ефекту відв/м’язевого введення атропіну (понад30 хв). Тому ефекти атропіну нерідко проявляються вже післяпроведення процедур, які знеболювалися кетаміном, що може погіршувати відчуття пацієнта впісляпроцедурному періоді. Не слід забувати, щов/м’язевий шлях введення теж досить неприємнийдля пацієнта і може супроводжуватися ускладненнями(особливо при змішуванні в шприці декількох препаратів).
Тому від рутинного введення дляпремедикації наркотичних анальгетиків, антигістамінних, атропіну в більшості розвинених країнвідмовилися. Крім того, у разі необхідності препарати вводять не в/м’язево а ентерально(менше неприємних відчуттів та стресу) або в/венно– більшпрогнозований та контрольований ефект.
Деякі медикаменти, що призначені для парентерального введення, такі як мідазолам, дексмедетомідин, фентаніл замість в/м’язевого шляху вводити можна інтраназально у вигляді спрею чи крапельно. Таке введення мало поступається за ефективністю, але значно комфортніше пацієнту, ніж в/м’язеве.
Ентеральні форми премедикації. З доступних в Україні седативних препаратів ентерально можуть бути використані таблетки фенобарбіталута гідазепаму. Ці препарати мають тривалий періоднапіввиведення тому можуть суттєво подовжувати післяпроцедурну седацію, що суттєво обмежує їх рутинне застосування. Серед анальгетиків перевагу надають таблеткам, капсулам чи розчинним формам парацетамолу 500-1000 мг. Іноді ентерально дають дексаметазон 4-6 мг, хоча більш обґрунтованим є його в/венне введення безпосередньо перед початком ПС.
Бензодіазепіни для премедикації. Якщо донедавна часто застосовували в/м’язово сибазон (у молодших дітей до 0,5-0,6 мг/кг, у старших дітей тадорослих 0,1-0,15 мг/кг, але не більше 10 мг) за 60 хв. до початку ПС, то зараз в/м’язевий шлях йоговведення застосовують рідко, особливо у дорослих. У разі необхідності проведення премедикаціїсибазон ліпше застосовувати в/венно з титрацієюдози по 13 мг, до досягнення необхідного седативного ефекту, але не більше10 мг.
За доступності мідазоламу цей препарат теж титрують по 1-3 мг і з урахуванням меншого періоду його напіввиведення він має суттєві переваги перед сибазоном. Значно раніше в педіатричній практиці, а останнім часом і у дорослих все частіше мідазолам застосовують інтраназально (за15-30 хв. до постановкивенозного катетера в дозі до10 мг у дорослих) з урахуванням його біодоступності 30-40%.
Дексмедетомідин для премедикації. На сьогодні поряд з мідазоламом оптимальним препаратом для премедикації можна вважати дексмедетомідин в дозі 0,3-0,5 мкг/кг, який вводять протягом 5-10 хв. Ефект від такої премедикації наступає протягом наступних 5-10 хв. Спочатку в педіатричній практиці, а згодом і у дорослих накопичується все більше даних про ефективність та безпечність інтраназального розпилення (небулізації) або крапельного введення дексмедетомідину в дозі близько1 мкг/кг[13].
Ефект премедикації від такого введення наступає суттєво пізніше, ніж після в/венного введення– всередньому через 45-60 хв, що певною міроюобмежує застосування цього препарату для зняття стресу на пункцію вени. [14]. Біодоступність дексмедетомідину при інтраназальному введенні– близько 40%, що вважається цілком прийнятним показником. Для країн, що розвиваються, втрата 60 % препарату може бути суттєвим обмеженням для широкого рутинного застосування інтраназальної премедикації.
З іншого боку, якщо ПС короткотривала чи середньої тривалості (до 3 год.), то застосування всього вмістуампули/флакону дексмедетомідину не доцільне, тому майже завжди після ПС залишається певнакількість препарату. У такому разі введення інтраназальне введення навантажувальної дози 1 мкг/кг за 30-45 хв до початку ПС можна вважати цілком обґрунтованим.
Венозний доступ. У разі, коли периферичний венозний доступ встановлюють після премедикації, то це приносить пацієнту менше дискомфорту. Якщо ж премедикацію не робили, то бажано під час встановлення доступу відволікатипацієнта якимось важливими запитаннями, поясненнями чи іншими процедурами(наприклад, вимірюванням АТ). Загальновизнаних вимог додіаметру в/венного катетеру не встановлено, алеу дорослих для проведення планової ПС найчастіше встановлюють наступні катетери:
• зелений– 18 G, що пропускає 90-100 мл рідини за хвилину;
• рожевий– 20 G, 60-67 мл/хв;
• синій– 22 G, пропускає 31-36 мл/хв.
Всі автори погоджуються, що венозний доступ повинен бути надійним, тому у разі будьяких сумнівів у правильному положенні катетерата його функціонуванні слід провести повторну катетеризацію вени. По закінченню ПС венозний катетер видаляють після повного пробудження, коли ризики депресії дихання та серцево-судинної системи стають мінімальними.
Фіксація та стабілізація пацієнта під час процедурної седації. До цього часу медичні покази до седації в багатьох галузях медицинипід час проведення болючих чи психологічно неприємних процедур остаточно не визначені ані у дорослих, ані у дітей. Разом з тим в багатьох установах, особливо в педіатричних, в рутинну практику входить протективна фіксація пацієнтів. Не до кінця визначено також взаємозв’язок між седацією та фіксацією пацієнта і на важливість цього питання вказує те, що проведення рандомізованих досліджень у цьому напрямку продовжується[15].
З іншого боку практика багатьох досвідчених анестезіологів свідчить про те, що за умови ретельного та детального пояснення пацієнту безпеки тапереваг фіксації його кінцівок, а іноді і голови та отримання його усвідомленої інформованої згоди, в т.ч., на таку фіксацію несе в собі багато позитивних моментів.
МОНІТОРИНГ ПІД ЧАС ПС
Моніторинг глибини седації рівня знеболення чи антиноцицептивного захисту за клінічними ознаками. При проведенні ПС важливим є нетільки моніторинг рівня седації та знеболення, а й їх відповідність інтенсивності самих процедур. При мінімальній та помірній седації про її рівень свідчать передусім регулярні відповіді пацієнта назапитання та здатність виконувати прості інструкції (наприклад, підняття великого пальцю доверху або потискання руки).
При глибокій седації та анестезії на перший план виходять несвідомі(мимовільні) відповіді пацієнта на інтенсивні больові/ноцицептивні подразники: відкривання очей, гримаса болю, інтенсивність рухів кінцівок, а такожрівні АТ, ЧСС, а також глибина та регулярність дихання.
Моніторинг прохідності ДШ, частоти та глибини дихання. Оскільки при проведенні ПС глибина седації, а отже і ступінь порушення прохідності верхніх ДШ, а також частоти та глибинидихання може швидко змінюватися, то моніторинг цих показників є абсолютно необхідним.
Ступінь прохідності верхніх ДШ при помірній седаціївизначають за спроможністю говорити, а приглибокій седації– за підтримкою чи, навпаки, западінням нижньої щелепи. Крім того, при западінні нижньої щелепи за збереженого самостійного дихання виникають характерні для обструкції звуки – хропіння, які при правильному виведенні нижньої щелепи, зникають.
Для моніторингу частоти та глибини дихання спостерігають за екскурсіямигрудної клітки та живота. Такі екскурсії добре візуалізуються, коли нижня частина грудної клітки таживіт пацієнта відкриті, проте це може перешкоджати зігріванню пацієнта. Тому завжди слід знаходити компроміс між укриванням пацієнта для його зігрівання і розкриттям ділянки екскурсії діафрагми для моніторингу його дихальних рухів.
Пульсоксиметрія. Проведення пульсоксиметрії вже увійшло в рутинну клінічну практику ПС вУкраїні, хоча якість такого моніторингу може суттєво відрізнятися. Якісні стаціонарні пульсоксиметри(передусім ті, які інтегровані в багатофункціональні монітори пацієнта) дозволяють:
• порівняно точно визначати рівень сатурації в широких межах(в т.ч. і при вираженійгіпоксемії таSpO2< 70%);
• візуалізувати криву плетизмографії; за амплітудою кривої плетизмографії можна опосередковано судити про адекватність перфузії тканин;
• встановлювати межі тривог;
• зберігати тренди сатурації та ЧСС для внесення показників до медичної документації.
В Україні в багатьох місцях, на жаль, пульсоксиметрію все ще проводять за допомогою дешевихпортативних пульсоксиметрів, що мають за джерело живлення пальчикові батареї, і в яких маленький екран інтегрований в сам датчик. Такі портативні пульсоксиметри мають суттєві недоліки і їх використання може супроводжуватися певними ризиками:
• сумнівна точність визначення сатурації привираженій гіпоксемії(SpO2< 70%);
• порівняно низька якість сигналу при низькому АТ та порушенні периферичного кровообігу(гіпоперфузії тканин пальців руки);
• відсутність кривої плетизмографії;
• погана візуалізація показників на відстані;
• низька надійність та додаткові ризики ушкодження при інтенсивних рухах пацієнта.
Виходячи з цього, у пацієнтів, в яких планується проведення тривалої ПС і в яких є ризики розвитку клінічно значимих порушень функції диханнята кровообігу, анестезіологу слід докласти зусиль для використання якісних моніторів пацієнта, що мають якісні пульсоксиметричні датчики.
У переважній більшості випадків при тривалих ПС цільовими повинні бути рівнями SpO2 95-98%. Підтримувати гіпероксигенацію(високу сатурацію– SpO2 99-100%) за рахунок підвищення потоку кисню та його інспіраторної фракції(FiO2) неслід внаслідок декількох причин:
• токсичного впливу високих концентраційкисню на легені та підвищення ризику ателектазів;
• хоча при гіповентиляції десатурація і розвивається повільніше(позитивний ефект), але її діагностика може суттєво затримуватися ітоді, вже на фоні вираженої гіповентиляціїпадіння сатурації може бути душе швидким;
• при SpO2 95-98%, у разі неадекватної седації та знеболення пацієнт напружується, активуються його експіраторні м’язи, знижується функціональна залишкова ємність легень, що проявляється зниженням сатурації на кілька відсотків; таке зниження сатурації може бути одним з ранніх ознакнеадекватного знеболення; у разі гіпероксигенації (SpO2 99-100%) зниження сатураціїу ві ення амплітуди пульсової хвилі може суттєво зростати при артеріальній гіпотензії. Так, наприклад, уразі виникнення зниження АТ до рівня 80/50 ммрт. ст. на фоні використання анестетиків, такихяк пропофол, дексмедетомідин або їх комбінації,або поглиблення ПС до рівня анестезії з використанням інших анестетиків, виникає запитання, чи такий тиск прийнятний для пацієнта? Якщо зниження АТ супроводжується збереженою чи навіть підвищеною амплітудою пульсової хвилі, то це є однією з ознак того, що така а ртеріальна гіпо тензіяє допус тимою(пермісивною). Іншою ознакою пермісивної гіпотензії могло би бути збереження свідомості, але при ПС, звісно, ця ознака втрачається.
У людини, що перебуває в свідомості, природноювідповіддю організму на гіпотензію є тахікардія, проте при застосуванні пропофолу, дексмедетомідину або їх комбінації, навпаки на фоні зниження АТ спостерігається брадикардія. Найбільш інформативним лабораторним показником адекватної глобальної перфузії могла б бути сатурація змішаної чи центральної венозної крові> 75%, проте аналіз газового складу крові малодоступний при проведенні ПС.
Про адекватність зниженого АТ для підтримання перфузії нирок можна було б судити за темпом діурезу, проте в більшості випадківпри ПС катетеризацію сечового міхура не проводять. Існує також цілий ряд неінвазивних методик визначення серцевого викиду, але жодна з них теж не стала широкодоступною в місцях проведенняПС.
Тому адекватність АТ при викликаній анестетиками артеріальній гіпотензії, як правило, визначають лише за клінічними ознаками(теплі кінцівки, швидке заповнення капілярного ложа нігтьової фаланги – симптом білої плями< 2с), а також зазбереженою чи навіть підвищеною амплітудою пульсової хвилі.
Моніторинг артеріального тиску (АТ). Збір анамнезу про вихідний тиск пацієнта, визначенняАТ до процедури(як завчасно, так і безпосередньо перед її виконанням), дає змогу оцінити бажаний та допустимий коридор АТ під час процедури.
Регулярне визначення АТ кожні 2, 3 чи 5 хв, а також додаткове його визначення під час процедур, а також після кожної найбільш болючої маніпуляції та після кожного болюсного введення анестетику дає змогу точніше визначити дози анестетика і ефективніше запобігати значним коливанням АТ.
На сьогоднішній день в багатьох (але далеко не у всіх) лікарнях під час анестезії рутинним вже стало автоматичне визначення АТ. Разом з тим в місцях проведення ПС монітори, які дозволяють визначати АТ, а також пульсоксиметрію, ЕКГ, температуру тіла доступні далеко не завжди.
Тому для проведення тривалих ПС, а також для пацієнтів з ризиками розвитку нестабільної гемодинаміки слід докласти суттєвих зусиль для забезпечення місць проведення ПС багатофункціональними моніторами. Особливо важливим є використання таких моніторів при поєднаному використанні анестетиків, які знижують АТ, наприклад, пропофолу з дексмедетомідином.
Капнографія. Під час швидкого поглибленняседації на фоні інгаляції кисню частота та глибинадихання можуть суттєво знижуватися і розвиватися клінічнозначима гіповентиляція, а зниження сатурації може відбуватися на декілька хвилин пізніше. У таких випадках використання капнографіїможе бути інформативним у ранній діагностиціобструкції верхніх ДШ та пригнічення дихання.
Так в декількох дослідженнях було продемонстровано, що застосування капнографії дозволяє суттєво зменшити частоту розвитку десатурації(SpO2< 90%) як у дорослих, так і у дітей[16, 17]. Разом з тим, для ефективного застосування капнографії необхідне щільне прилягання лицьової маски або спеціальні засоби, які дозволяють забирати зразки газу біля носових ходів пацієнта або з ротоглотки.Крім того, середньота високопотокова назальна чи фарингеальна оксигенація суттєво ускладнюють проведення капнографічного моніторингу.
Електрокардіограма (ЕКГ). ЕКГ моніторинг дозволяє виявляти аритмії, тому передусім повинен застосовуватися у хворих, схильних до їх виникнення – передусім із захворюваннями ССС.
При застосуванні пропофолу, дексмедетомідину або їх комбінації може виникати брадикардія. Тому при тривалих ПС проведення ЕКГмоніторингу в поєднанні з регулярним визначенням АТ та моніторингом амплітуди пульсової хвилі може бути запорукою безпеки пацієнта та спокою анестезіолога при брадикардії, що не супроводжується клінічнозначимими змінами гемодинаміки.
Моніторинг температури тіла. При тривалих ПС, особливо в холодну пору року, коли температура в приміщеннях може варіювати, суттєвогозначення набуває моніторинг температури тіла, а також пасивне чи активне зігрівання пацієнта.
Моніторинг глибини седації за біспектральним індексом електроенцефалографії (BIS). BIS-моніторинг найбільш важливий у пацієнтів,що потребують тривалої та глибокої ПС, в яких важко спрогнозувати вибір оптимальних доз анестетиків. Прикладами таких пацієнтів можуть бути ті, хто:
• прокидався при проведенні попередніх анестезій чи глибоких ПС і це призводило до глибокого стресу та вкрай неприємних спогадів; деякі пацієнти зазначають, що приминулих ПС їх пробудження супроводжувалось вираженими руховими реакціями і цепризводили до певних ускладнень;
• при проведенні попередніх анестезій чи глибоких ПС довго не міг прийти до свідомостіі це призводило до тривалого післяпроцедурного відновлення та інших ускладнень;
• після проведення попередніх анестезій відчували значне погіршення короткотривалої пам’яті, та в яких відмічались інші когнітивні розлади, що може бути пов’язано з нейротоксичною дією анестетиків на фоні тривалої та занадто глибокої анестезії;
• тривалий час приймають снодійні, психотропні засоби або зловживають ними, або мають залежність від наркотиків чи інших психотропних засобів;
• фактори ризику толерантності до анестетиків та швидкого їх метаболізму – наприклад зловживають алкоголем і можуть випити великі дози алкоголю при помірному сп’янінні– деякі пацієнти зазначають, що можуть випити понад1 л міцного алкоголю; при цьому багато з таких пацієнтів зазначають, що зі слів лікарів на попередніханестезіях чи ПС їх тяжко було вводити в наркоз;
• фактори ризику виникнення порушення прохідності ДШ та депресії дихання такі як надмірне ожиріння, синдром Піквіка, ХОЗЛ.
BIS-монітори в Україні все ще малодоступні в більшості місць, де проводять ПС, а високавартість датчиків диктує необхідність їх використання лише у тих випадках, де вони можуть змінити хід ПС та її ефективність та безпечність. Чим довша ПС, чим глибший її рівень необхідно підтримувати. І чим більше у пацієнта факторів ризику, тим більш обґрунтованим може бути проведення BIS-моніторингу там, де він доступний.
Так, за нашим досвідом, у декількох пацієнтів, які малиодночасно фактори як ризику пробудження(толерантність до анестетиків), так і депресії дихання (надмірна маса тіла та синдром Піквіка) проведення BIS-моніторингу суттєво допомагало у виборі доз анестетиків для підтримки оптимального рівня глибини седації. При проведенні глибокої ПС,а тим більше анестезії з BIS-моніторингом дозианестетиків ближче до кінця виконання процедури вдається знижувати раніше і пробудження, як правило, відбувається швидше.
Ведення наркозної карти чи іншої документації ПС. Питання про те, коли на проведення ПС слід заповнювати стандартизовану чи модифіковану наркозну карту, залишається відкритим. Зазвичай в Україні наркозну карту ведуть анестезисти, а в лікарів у цьому є обмежений досвід, тому далеко не всі лікарі є прихильниками заведення наркозної карти на проведення короткочи середньотривалих ПС.
Разом з тим, для підвищення безпеки пацієнта доцільно впровадити рекомендації щодо мінімальної кількості записів в медичну документацію з консенсусного гайдлайну комітетів по седації американських асоціацій анестезіологів, щелепнолицьових хірургів, радіологів, дантистів, а також стоматологічних анестезіологів [7]. Згідно цих рекомендацій вітальні функції слід документувати мінімум:
• до введення седативного/анестетика;
• після введення седативного/анестетика;
• з регулярними інтервалами протягом періоду виконання ПС;
• після закінчення ПС;
• перед випискою додому чи переведенням до палати.
ЗАБЕЗПЕЧЕННЯ ПРОХІДНОСТІ ДШ ТА ОКСИГЕНАЦІЇ ПІД ЧАС ПС
Загальні положення. При ПС рівень седації повинен бути таким, що не призводить до порушення прохідності верхніх ДШ. На практиці ж доситьчасто трапляється швидке та значне поглибленняседації, що супроводжується порушенням прохідності верхніх ДШ з розвитком гіпоксемії. Підходидо корекції цих порушень обирають залежно відглибини седації, її тривалості та інвазивності самих процедур – від відновлення прохідності ДШ простими прийомами та проведення інгаляції кисню до встановлення надійного контролю над ДШ та респіраторної підтримки.
При розвитку тяжкихреспіраторних ускладнень, особливо в поєднанні зпорушеннями функції ССС (передусім тяжкою артеріальною гіпотензією), на фоні будь-якої глибини седації анестезіолог завжди повинен бути готовий до невідкладної інтубації трахеї і проведенняШВЛ. В місці проведення ПС повинно бути підготовленим все необхідне обладнання для невідкладної інтубації, аспірації вмісту трахеї та ротоглотки, проведення ШВЛ.
Ризики розвитку порушення прохідності ДШ та десатурації. Ризики виникнення гіпоксемії (SpO2< 90%) під час ПС підвищуються припроведенні ПС не анестезіологами, а також припродовженні тривалості процедур[18]. В цьому дослідженні на вибірці близько 6 тис. пацієнтів було продемонстровано, що гіпоксемія (SpO2 < 90%, понад 2 хв) відмічалась приблизно у третини пацієнтів, яким проводили ПС.
Найчастіше гіпоксемія виникала при проведенні ПС при бронхоскопіях– в 56% пацієнтів. Порушення чи втрата прохідності ДШ та клінічно значиме зниження сатурації найчастіше розвивається саме при неочікуваному і раптовому поглибленні седації до рівняанестезії, тому основним методом профілактикиє забезпечення стабільного рівня седації тренованим та досвідченим в ПС анестезіологом.
Слід пам’ятати, що при використанні найбільш потужних анестетиків, таких як пропофол чи тіопентал, седація може перейти (і досить часто переходить) на 1 рівень глибше від цільової і самеце визначає ступінь пригнічення дихання та диктує вибір заходів для підтримки прохідності ДШ. При порівнянні між собою тіопенталу та пропофолу ефект поглиблення седації наступає швидше при застосуванні тіопенталу і тривалість його дії довша.
Тобто при застосуванні найбільш популярного для ПС пропофолу вірогідність раптового прокидання вища, а часовий інтервал між початком введення пропофолу для поглиблення седаціїі самим ефектом поглиблення седації у пропофолу довший. Тому доза пропофолу, яку встигають ввести під час прокидання хворого, часто вища, ніжу тіопенталу. Виходячи з цього, ризик виникнення депресії дихання може бути вищий саме при застосуванні пропофолу, порівняно з будь-яким іншиманестетиком, включаючи тіопентал.
У разі, коли пробудження хворого розглядають як недостатню аналгезію і на пробудження окрім анестетика вводять ще й болюс наркотичного анальгетика (наприклад, фентанілу), слід пам’ятати, що час настання максимального ефекту фентанілу вимірюється не в десятках секунд, а в хвилинах.
Тому на момент настання мюопіоїдних ефектів фентанілу пацієнт найчастіше вже перебуває в поглибленій седації і ефекти депресії дихання часто посилюються. Для попередження цього оптимальний спосіб застосування опіоїдів– постійна інфузія з періодичним прискоренням темпу інфузіїза певний час до завдання пацієнту больових/ноцицептивних стимулів, а не після їх виникнення.
Порівняно з пропофолом та тіопенталом, такіпрепарати, як мідазолам і сибазон, а особливо кетамін та дексмедетомідин, значно менше викликають депресію дихання та порушення прохідності верхніх ДШ.
Інгаляція кисню. Інгаляція кисню під час ПС зменшує кількість ускладнень[17].
Інгаляцію кисню слід розпочати ще перед індукцією в седацію. На індукцію допустимо і навіть бажано проведення преоксигенації з використанням підвищеної чи високої концентрації кисню. Це роблять не тільки для досягнення підвищеної сатурації(> 98%) але і для проведення денітрифікації легень і створення в легенях резерву кисню.
В подальшому при досягненні необхідного рівня седації за збереженої прохідності верхніх ДШта адекватної глибини диханняFiO2слід знизитидо того рівня, який підтримує сатурацію в прийнятних межах– 94-97%.
Контроль ДШ та оксигенація залежно від глибини ПС. Штучна підтримка прохідності ДШ може бути необхідною при глибокій седації і майже завжди необхідна при подальшому поглибленні седації до рівня анестезії.
Мінімальна, поверхнева седація(анксіолізис) не потребує застосування заходів для контролюДШ та оксигенотерапії.
Помірна седація/анальгезія зазвичай не потребує застосування заходів для контролю ДШ таоксигенотерапії, проте у пацієнтів з вихіднимипорушеннями функції дихальної системи(помірне знижена сатурації у спокої) може знадобитися інгаляція кисню з низьким потоком(23 л/хв, FiO2 0,25-0,3) через назальні канюлі чи лицьову маску.
Глибока седація/анальгезія може потребувати застосування заходів дл я контролю ДШ та оксигенотерапії з низьким потоком(23 л/хв, FiO2 0,25-0,3). У пацієнтів зі схильністю до обструктивногоапное вірогідно буде потребувати забезпечення прохідності ДШ шляхом встановлення назо чиорофарингеального повітроводу або мануального виведення щелепи або застосування потрійного прийому Сафара.
У пацієнтів з вихідними порушеннями функції дихальної системи (помірнезнижена сатурації у спокої) може знадобитися інгаляція кисню з помірним(35 л/хв, FiO2 0,3-0,5) чи середнім потоком(5-10 л/хв, FiO2 0,5-0,7) ч/зназальні канюлі, лицьову маску чи ліпше ч/з назофарингеальний повітровод. В окремих випадках при помірній обструкції верхніх ДШ можна застосовувати високопотокову оксигенацію(10-20 л/хв, FiO2 0,5-0,7) через назофарингельний повітровід або дитячу ентотрахеальну трубку і це д ає змогууникати проведення потрійного прийому Сафара.
Інсуфляція кисню через назофарингеальний катетер чи повітровід, кінець якого розташованийнад входом в гортань є одним з найбільш дієвих засобів оксигенації. Якщо ж замість назофарингеальної інсуфляції кисню використовують назальніканюлі чи назальну маску, то потік повітрянокисневої суміші для продування через місце часткової обструкції верхніх ДШ повинен бути суттєво вищим – понад 30 л/хв.
При повній обструкції верхніх ДШ негайна ліквідація цієї обструкції абсолютно необхідна, а інгаляція кисню повинна лише доповнювати, а не заміняти.
Загальна анестезія завжди потребує застосування заходів для контролю ДШ (повітроводи, ларингеальні маски, інтубація трахеї) та оксигенотерапіїз середнім чи високим потоком(від 5 л/хв, FiO2 > 0,3).
Як зазначалось вище, при використанні для ПС пропофолу(особливо в поєднанні з наркотичними анальгетиками) слід завжди бути готовим, що седація може перейти на 1 рівень глибше від бажаної і саме це визначає ступінь пригнічення дихання тадиктує вибір заходів для підтримки прохідності ДШ.
При відсутності можливості надійного забезпечення прохідності ДШ під час неочікуваного поглиблення ПС слід заздалегідь обмежити використання потужних анестетиків, таких як пропофол, тіопентал, та обмежити їх поєднання з опіоїдами. У таких випадках перевагу варто надавати препаратам зі стабільнішим рівнем седації та меншим впливом на дихальну систему, таким як мідазолам, декседетомідин.
Антагоністи опіоїдів та бензодіазепінів. На сьогоднішній день використання для ПС як опіоїдівтак і безнодіазепінів суттєво скоротилося, тому іїх передозування відбувається вкрай рідко. Якщо ж таке передозування відбулося, то слід передусім сконцентруватися на заходах підтримки прохідності верхніх ДШ, оксигенації, а при необхідностіі респіраторній підтримці. Титроване використання налоксона (антагоніста опіоїдних рецепторів) та флюмазеніла(антагоніста бензодіазепінів) можливе лише після забезпечення оксигенації.
Крім того, при застосуванні налоксону, період напіввиведення якого значно коротший, ніж в опіатів, слід уважно спостерігати за пацієнтом і контролювати можливе виникнення«ренаркотизації» після припинення його дії. В будь-якому випадку слід уникати планування введення високих доз опіоїдів табензодіазепінів в розрахунку на реверсію їх ефектів налоксоном та флюмазенілом.
НЕБАЖАНІ ЯВИЩА ТА УСКЛАДНЕННЯ ПІД ЧАС ПС, ЇХ ЗАЛЕЖНІСТЬ ВІД ГЛИБИНИ ПС ТА МЕТОДИ ПОПЕРЕДЖЕННЯ
Небажані явища та ускладнення під час ПС. Якщо під час ПС трапилась якась несприятлива подія (наприклад, блювота чи кровотеча) або якесь клінічно значиме відхилення фізіологічних показників від норми(наприклад зниження сатурації< 80% чи артеріальна гіпотензія– АТ< 80 мм рт. ст.), то виникає питання«Як характеризувати цюподію?».
В Україні склалася практика, що подібні відхилення характеризують, як ускладнення, ітому в багатьох випадках в наркозній карті їх просто не реєструють. В розвинених країнах, навпаки всі такі випадки ретельно реєструють, але їх класифікують не як ускладнення, а як небажані явища (НЯ). За визначенням ВООЗ, небажаним явищем вважають медичний випадок(відхилення), пов’язаний із застосуванням лікарського засобу, але цей зв’язок не обов’язково повинен бути причинно-наслідковим[20].
Більш зрозумілим є визначення НЯ, наведене на сайті американського Національного інституту раку: несподівана медична проблема, яка трапляється під час лікування медикаментозною або іншою терапією[21]. В тойже час в термін«ускладнення» вкладуть довготривалі ефекти, тобто нове захворювання або стан, доякого пр извів перебіг захворювання чи процедури. Тобто небажані явища часто завершуються без несприятливих наслідків, тоді як ускладнення цеі є несприятливими наслідками захворювання чи процедури.
Окрім НЯ, існує також термін серйозного небажаного явища (СНЯ– serious advers events – SAE), який раніше використовували переважнов клінічних дослідженнях, але останніми роками дедалі частіше застосовують і рутинній клінічній практиці. Під терміном СНЯ розуміють ті НЯ, які призводять до смерті, загрози життю, госпіталізації або подовженню попередньої госпіталізації, виникненню стійких дефектів або розладів(наприклад, вибитий зуб, втрата зору) [22].
Тобто СНЯ єбагато в чому синонімом ускладнень чи тяжких ускладнень, але термінологічно цей термін не передбачає автоматичної вини лікаря, як це звикли, коли використовували термін ускладнення. Надумку провідних експертів, виявлення та реєстрація/документація небажаних явищ(НЯ–advers events –AE) та серйозних небажаних явищ (СНЯ– serious advers events – SAE), а також їх відкрите обговорення з колегами є ключовим чинником підвищення безпеки процедурних седацій[23]. Врозвинених країнах давно закріпилась практика ретельної та точної реєстрації не тільки НЯ, але іСНЯ та ускладнень та необвинувачуваного їх обговорення та прагнення попереджати в майбутньому.
Найчастішими з СНЯ при процедурній седації поза межами операційної були клінічно значимі артеріальна гіпотензія та десатурація[24]. Слід зазначити, що в цьому дослідженні в групах, дебули СНЯ, і там, де їх не відмічалося, дози фентанілу та мідазоламу не відрізнялися, а от доза пропофола була вищою (хоча ця різниця й не набула статистичної достовірності).
Артеріальна гіпертензія та надмірна стресорна відповідь. Високий АТ внаслідок надмірного викиду катехоламінів найчастіше пов’язаний знедостатнім рівнем знеболення і, меншою мірою, седації. Найбільш несприятливими, але на щастя рідкими, наслідками екстримальної артеріальної гіпертензії можуть бути крововиливи в різні органи(наприклад, геморагічний інсульт), набряк мозку, набряк легень, ішемія міокарду. Тому можна стверджувати, що якісно проведена ПС не підвищує, а знижує вірогідність гіпертензивних ускладнень, і це слід брати до уваги при оцінці показів/протипоказів.
У пацієнтів з вираженою артеріальною гіпертензією доцільно використовувати дексмедетомідин в поєднанні з пропофоломв дозах, що помірно, але стабільно знижують АТ відповідно до інстурукції. Слід ретельно уникатираптового та надмірного зниження АТ, тому препарати бажано титрувати повільно, із застосування мінфузомату чи вводити крапельно на розведенні, ніж болюсно.
Артеріальна гіпотензія. Зниження тиску підчас ПС може бути пов’язане як з дією седативних/анестетиків, таких як пропофол або дексмедетомідин, чи особливо з їх поєднанням, а може бути пов’язане з вираженою гіповолемією у пацієнта.
Зазвичай хворі добре переносять помірну артеріальну гіпотензію під час ПС і це може бути обумовленим відразу декількома причинами:
• гіпотензія виникає внаслідок вазодилятації, а величина серцевого викиду знижується мінімально, тому перфузія органів зберігається;
• внаслідок седації знижується потреба мозкув кисні;
• в горизонтальному положенні для перфузіїмозку необхідний менший АТ, ніж у вертикальному;
• серед внутрішніх органів найбільш чутливим до гіпотензії є кишківник, але до планової ПС пацієнт якийсь час голодував, тому функціональне навантаження на кишківник знижене і його потреба в кисні зменшується.
Таким чином, артеріальну гіпотензію можна вважати допустимою або пермісивною за наступних умов:
• гіпотензія виникає внаслідок вазодилятаціївикликаної анестетиками, а не вираженоїгіповолемії;
• зберігається адекватний периферичний кровотік (як маркер перфузії внутрішніх органів), про що свідчать теплі пальці рук та ніг, висока амплітуда пульсової хвилі плетизмограми (пульсоксиметрії), швидке заповнення капілярного ложа нігтьової пластинки пальців рук;
• сатурація підтримується на нормальному рівні за рахунок проведення оксигенотерапії;
• у пацієнта відсутня як гіперкапнія(пов’язана з депресією дихання), так і гіпокапнія(пов’язана з гіпервентиляцією внаслідок неадекватного знеболення);
• відсутність у хворого даних за ішемію будь-яких органів та систем чи симптомів/маркерів їх ішемії(мозку, міокарду, нирок, кінцівок).
Окрім того, що гіпотензія може бути побічноюдією анестетиків з притаманними їй ризиками, напроцедурах, пов’язаних з кровотечею вона може мати і суттєвий позитивний момент– зменшувати крововтрату.
Однозначного, науковообґрунтованого і загальновизнаного рівня артеріальної гіпотензії, який можна вважати «небажаним явищем» припроведенні седації не встановлено. У осіб без патологічних змін в ЦНС ауторегуляція мозкового кровотоку спрацьовує до середнього артеріальноготиску50 мм рт. ст.
Тобто більшість авторів погоджуються у тому, що тривала артеріальна гіпотензіяз тиском менше ніж70/40 мм рт. ст. може бути фактором ризику ішемії мозку. Разом з тим, під час деяких операцій на ЦНС для зменшенн я крововтратиі полегшення роботи нейрохірургів такі тиски цілком безпечно та з успіхом застосовуються протягом декількох годин наркозу і хворі повною міроюпробуджуються.
Для нирок безпечним тиском вважають САТ 60 мм рт. ст. (наприклад, АТ 80 /50 ммрт. ст.), але ж знову ж таки існує великий досвід гіпотензи вної анестезії в ортопедії, нейрохірургії та інших галузях хірургії де й нижчі тиски непризводили до клінічнознралядатися як«небажане явище».
Найбільш чутливими до артеріальної гіпотензії є хворі з тривалою та погано контрольованою гіпертонічною хворобою, в яких«робочий» САТ перевищує 120 мм рт. ст. (наприклад, АТ 160/100 мм рт. ст.). У таких хворих дуже часто є виражені атеросклеротичні зміни в судинах різних органів, ауторегуляція кровотоку в цих органах працює малоефективно, і їх перфузія цілком залежить відпідтримання хоча б помірно підвищеного АТ.
Зниження САТ на понад30 % може сприяти виникненню клінічно значимої ішемії головного мозку, міокарду, нирок та інших органів, в судинах якихатеросклеротичні зміни найбільш виражені. Такимчином тиск90/60 під час ПС хворих з вираженоюартеріальною гіпертензією може нести в собі суттєві ризики ішемічного ушкодження певних органів, а тому така гіпотензія повинна вже розглядатися як«небажане явище».
Брадикардія. Зниження ЧСС під час ПС можебути проявом зниження стресу і концентрації катехоламінів або прямим наслідком негативного хронотропного ефекту, як анестетиків, такихяк пропофол, дексмедетомідин, мідазолам, так інаркотичних аналгетиків, такий як фентаніл[25].
Хоча існує думка про те, що мідазолам викликає брадикардію меншою мірою, ніж пропофол тадексмедетомідин, в одному з досліджень частотабрадикардії при застосування мідазоламу та пропофолу достовірно не відрізнялась[26].
Клінічна значимість брадикардії може бути пов’язана з викликаним нею зниженням АТ, атакож з ризиком виникнення аритмій, чи навіть асистолії. Разом з тим, точних значень ЧСС, які асоціюються з цими ризиками не встановлено.
Так, у фізично здорових та добре тренованих людей про введення атропіну під час ПС досвідченіанестезіологи думають при ЧСС< 50/хв, але успортсменів така ЧСС може бути в спокої варіантом норми. Не узгодженими є і дозування атропінупри виникненні брадикардії.
Існують рекомендаціїщодо застосування атропіну у дорослих в дозі не менше 0,4 мг (0,4 мл 0,1% р-ну) для попередження парадоксальних реакцій. Разом з тим на практиці, багато анестезіологів з успіхом його застосовуютьі в менших дозах– 0,20,3 мг і в більшості випадків не отримують парадоксальних реакцій чи побічних ефектів.
Нудота та блювота. Більшість анестетиків, які використовують при планових ПС прямо не викликають нудоти та блювоти, а для пропофолу властивий навіть помірний протинудотний ефект. Кетамін та наркотичні анальгетики, починаючи зсередніх доз можуть викликати нудоту та блювотуяк під час ПС, так і по її завершенню. Це є однимз факторів, які спонукають до обмеження застосування кетаміна та опіоїдів загалом та їх доз зокрема під час ПС.
У разі виникнення блювоти під час ПС у пацієнта, який перебуває в положенні на спині суттєво зростають ризики аспірації шлункового вмісту до трахеї та бронхів. Тому важливим аспектом безпеки пацієнта є медикаментозна та немедикаментозна профілактика нудоти та блювоти.
Мимовільне сечовиділення. При тривалих ПС вірогідність виникнення мимовільного сечовипускання суттєво зростає після 4-ї години від початку її проведення. Тривалі ПС є рутинною практикою встоматології, пластичній та ендоваскулярній хірургії (див. заключну частину цієї с ерії публікацій про ПС). У таких випадках намагаються обмежити об’єм інфузії, час процедури та ПС, а якщо це складно, то хворому надягають памперс. При ПС в стоматології у багатьох досвідчених анестезіологів відпрацьована практика пробудження пацієнта після 4-ї години з метою відвідання туалету, а після цього поновлення виконання стоматологічних процедур та ПС.
Гіпотермія. Як під час анестезії, так і протягом ПС під дією анестетиків виникає периферична вазодилятація і втрата тепла суттєво збільшується. Разом з тим, глибина седації та ступінь порушення теморегуляції під час ПС менші, ніж під час загальної анестезії. Крім того, на відміну від анестезії, при ПС багато пацієнтів мають на собі якийсь одяг.
Все це знижує настороженість анестезіолога щодо виникнення гіпотермії і не спрямовує зусиль на її профілактику та лікування навіть при тривалій ПС. При помірному зниженні температури тіла можуть виникати такі небажані явища як підвищенняпродукції сечі та мимовільне сечовиділення, післяопераційне тремтіння (дрижання).
При більш вираженій гіпотермії може бути порушення згортання крові та подовження кровотеч. Все це диктуєнеобхідність укривання хворих (пасивне зігрівання), а у випадках тривалих процедур у приміщеннях зі зниженою температурою повітря необхідний моніторинг температури і активне зігрівання хворих з допомогою спеціальних засобів.
НЕОБХІДНІСТЬ ТРЕНІНГІВ ПС
Анестезіологи, які працюють лише в операційній, не завжди готові до проведення ПС. Вони, як правило, звикли до проведення більш глибоких анестезій і мимовільні рухи пацієнта, а також можливість його часткового пробудження під часПС сприймають як неадекватність анестезіологічного супроводу.
Тому, ті анестезіологи, що не мають спеціальних тренінгів чи регулярної клінічної практики з ПС, схильні проводити більш глибокі седації, що несе в собі ряд ризиків та незручностей:
• повне відновлення свідомості відбувається пізніше;
• вищі ризики розвитку ускладнень;
• потребують застосування більш інвазивних методів забезпечення прохідності ДШ та ретельнішого моніторингу, що суттєво здорожує виконання ПС.
Якщо ж ПС проводять не анестезіологи, а лікарі, які мають обмежений досвід в підтримці прохідності ДШ та забезпеченні оксигенації, товони схильні проводити занадто поверхневу ПС. Такий підхід несе в собі ризики значної рухової активності, яка може заважати виконанню самої процедури, а також значного підйому АТ з ризиками посилення кровотечі та інших ускладнень.
Виходячи з цього, за кордоном розроблені окремі курси та тренінги з ПС, а також віртуальні симулятори, які дозволяють моделювати як стандартну відповідь пацієнта на ПС, так і складні клінічні випадки. В Україні цей напрямок поки що перебуває на етапі становлення. Серед інших варто виділити роботу, яку проводить громадська організація(ГО) «Українська асоціація седації таанестезії в стоматології», яка проводить широку освітню діяльність (щорічні конференції).
Асоціація має свою сторінку в соціальних мережах та включає понад сто активних членів. Проте діяльність навіть однієї потужної ГО не достатня для того, щоб охопити всі напрямки ПС та всі регіони України, тому з часом необхідно розвивати цей напрямок освітньої діяльності на базі закладів післядипломної освіти.
ОЦІНКА ПОВНОТИ ПРОБУДЖЕННЯ ТА ГОТОВНОСТІ ДО ПЕРЕВЕДЕННЯ ДО ПАЛАТИ ТА ДО ВИПИСКИ
Окрім клінічного досвіду в оцінці готовності пацієнтів до переведення до палати чи до виписки додому важливо використовувати стандартизовані шкали. Найбільшого розповсюдження отримали шкала Альдрете, розроблена в 1970 р. і модифікована в 1995 р. [25], а також модифікована шкала постанестетичної виписки(PADSS) [28].
Шкала Альдрете включає 5 показників, кожен з яких оцінюється від 0 до 2 балів:
- Сатурація(2 бали– SpO2> 92% при диханні повітрі).
- Функція дихання (2 бали– глибоке дихання і можливість кашляти).
- Артеріальний тиск (2 бали– ±20 мм рт. ст. від «робочого» тиску).
- Рівень свідомості (2 бали– повна свідомість).
- Активність (2 бали– рухи у всіх кінцівках).
На сьогоднішній день в наукових публікаціях найчастіше згадується шкала PADSS, яка була валідизована в дослідженні у 2432 пацієнтів [29]. В цій шкалі відсутні сатурація та глибина дихання, натомість є критерії болю, нудоти, а також інтенсивності кровотечі. Критерієм готовності до виписки за обома шкалами є оцінка ≥9 балів.
Окрім показників, зазначених в шкалах, анестезіолог повинен оцінити відновлення свідомості та орієнтації в просторі та часі на передпроцедурному рівні а також можливість вставати та ходити без запаморочення.
Окрім бажання та готовності пацієнта до виписки додому важливо також, щоб з пацієнтом була особа, що його супроводжує додому. Важливо також домовитися з пацієнтом чиособою, що його супроводжує, про дзвінок додому з метою контролю відновлення після процедури та ПС.
ВИСНОВКИ
- При проведенні планових ПС необхідно забезпечити такий рівень седації та аналгезії, приякому пацієнт буде толерантним до неприємних процедур за збереження адекватного самостійного дихання та без виражених змін АТ.
- На відміну від анестезії, ПС не дає змогу повною мірою запобігати рухам пацієнта під час інтенсивних больових/ноцицептивних стимулів і проблему рухів вирішують не стільки поглибленням седації, а покращення знеболення, фіксацією пацієнта, а також детальним роз’ясненням йому необхідності лежати спокійно.
- Серед доступних в Україні препаратів для ПС на сьогоднішній день оптимальними є пропофол в поєднанні з дексмедетомідином, і таке поєднання дозволяє суттєво знизити дози пропофолу і викликану ним депресію дихання.
- Якщо при поверхневій седації (анксіолізисі) найчастіше не потрібно ані проведення інгаляції кисню, ані штучного забезпечення прохідності дихальних шляхів, то глибока седація потребує використання обох методів; одним знайбільш простих та дієвих засобів оксигенації є інсуфляція кисню через назофарингеальний катетер чи повітровід.
- Як і під час анестезії, під час ПС можуть траплятися небажані явища та ускладнення, тому, отримання інформованої згоди пацієнта на ПС, з урахуванням оцінки ризиків, а також сумісне рішення про місце виконання процедур та ПС, необхідність залучення для її виконання додаткового обладнання та ресурсів є компонентами безпечного виконання ПС.
Фінансування: немає джерела фінансування.
Конфлікт інтересів: усі автори повідомляють про відсутність конфлікту інтересів.
Етичне схвалення: це дослідження було проведено відповідно до Гельсінської декларації та затверджено місцевим комітетом з етики досліджень.
Автори:
Пилипенко М.М., Відділення анестезіології та ІТ Інституту нейрохірургії ім. акад. А.П. Ромоданова НАМН України, Київ
Михайлов Б.В., ПрАТ «Клініка Мотор-Січ», Запоріжжя
Література:
- Dossa F, Megetto O, Yakubu M, et al. Sedation practices for routine gastrointestinal endoscopy: a systematic review of recommendations BMC Gastroenterol. 2021; 21: 22.
- Hinkelbein J, Lamperti M, Akeson J, et al. European Society of Anaesthesiology and European Board of Anaesthesiology guidelines for procedural sedation and analgesia in adults. European Journal of Anaesthesiology. 2017; 35:6-24.
- ACEP Clinical Policy: Procedural Sedation and Analgesia in the Emergency Department. Ann Emerg Med. 2014;63:247-258.
- Prabhakar H, Tripathy S, Gupta N, et al. Consensus Statement on Analgo-sedation in Neurocritical Care and Review of Literature. Indian J Crit Care Med. 2021 Feb; 25(2): 126–133.
- Neme D, Aweke Z, Micho H, et al. Evidence-Based Guideline for Adult Sedation, Pain Assessment, and Analgesia in a Low Resource Setting Intensive Care Unit: Review Article. Int J Gen Med. 2020; 13: 1445–1452.
- Rasheed AM, Amirah MF, Abdallah M, et al. Ramsay Sedation Scale and Richmond Agitation Sedation Scale: A Cross-sectional Study. Dimens Crit Care Nurs. Mar/Apr 2019;38(2):90-95.
- Practice Guidelines for Moderate Procedural Sedation and Analgesia 2018. A Report by the American Society of Anesthesiologists Task Force on Moderate Procedural Sedation and Analgesia, the American Association of Oral and Maxillofacial Surgeons, American College of Radiology, American Dental Association, American Society of Dentist Anesthesiologists, and Society of Interventional Radiology. Anesthesiology. 2018; 128(3):437-479.
- Kim KN, Lee HJ, Kim SY, Kim JY. Combined use of dexmedetomidine and propofol in monitored anesthesia care: a randomized controlled study. BMC Anesthesiol. 2017 Mar 1;17(1):34.
- Ghisi D, Fanelli A, Tosi M, et al. Monitored anesthesia care. Minerva Anestesiol. 2005 Sep;71(9):533-8.
- Database of Abstracts of Reviews of Effects (DARE): Centre for Reviews and Dissemination (UK). Analgosedation: a paradigm shift in intensive care unit sedation practice. 2012. Available from: www.ncbi.nlm.nih.gov/books/NBK98957/
- Bell A, Treston G, McNabb C, et al. Profiling adverse respiratory events and vomiting when using propofol for emergency department procedural sedation. Emerg Med Australas 2007; 19:405–10.
- Practice Guidelines for Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration: Application to Healthy Patients Undergoing Elective Procedures: An Updated Report by the American Society of Anesthesiologists Task Force on Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration. Anesthesiology 2017; 126:376–393.
- Yao Y, Sun Y, Lin J, et al. Intranasal dexmedetomidine versus oral midazolam premedication to prevent emergence delirium in children undergoing strabismus surgery: A randomised controlled trial. Eur J Anaesthesiol. 2020 Dec;37(12):1143-1149.
- Li A, Yuen VM, Goulay-Dufaÿ S, et al. Pharmacokinetic and pharmacodynamic study of intranasal and intravenous dexmedetomidine. Br J Anaesth. 2018;120:960–968.
- da Silva GS, Anabuki AA, Viana KA, et al. in CEDACORE Collaborative Group. Sedation versus protective stabilization for dental treatment of children with caries and challenging behavior at the dentist (CHOOSE): a study protocol for a non-randomized clinical trial. BMC Oral Health. 2021; 21: 256.
- Mehta PP, Kochhar G, Albeldawi M, et al. Capnographic monitoring in routine EGD and colonoscopy with moderate sedation: A prospective, randomized, controlled trial. Am J Gastroenterol 2016; 111:395–404.
- Langhan ML, Shabanova V, Li FY, et al. A randomized controlled trial of capnography during sedation in a pediatric emergency setting. Am J Emerg Med 2015; 33:25–30.
- van Schaik E.P.C., Blankman P., Van Klei W.A. et al. Hypoxemia during procedural sedation in adult patients: a retrospective observational study. Can J Anesth/J Can Anesth (2021) www.doi.org/10.1007/s12630-021-01992-6
- Deitch K, Chudnofsky CR, Dominici P, et al. The utility of high-flow oxygen during emergency department procedural sedation and analgesia with propofol: A randomized, controlled trial. Ann Emerg Med 2011; 58:360–364.e3.
- www.who.int/medicines/areas/quality_safety/safety_efficacy/trainingcourses/definitions.pdf
- www.cancer.gov/publications/dictionaries/cancer-terms/def/adverse-event
- www.who.int/medicines/areas/quality_safety/safety_efficacy/trainingcourses/definitions.pdf
- Mitra M, Basu M, Shailendra K, Biswas N. Risk reduction in anesthesia and sedation—An analysis of process improvement towards zero adverse events. J Family Med Prim Care. 2020 Sep; 9(9): 4592–4602.
- Sirimontakan T, Artprom N, Anantasit N. Efficacy and Safety of Pediatric Procedural Sedation Outside the Operating Room Anesth Pain Med. 2020 Aug; 10(4): e106493.
- Hayashi T, Mizukami A, Kuroda S, et al. Outcomes of deep sedation for catheter ablation of paroxysmal supraventricular tachycardia, with adaptive servo ventilation. J Arrhythm. 2020 Dec 5;37(1):33-42.
- Demiraran Y, Korkut E, Tamer A, et al. The comparison of dexmedetomidine and idazolam used for sedation of patients during upper endoscopy. A prospective, randomized study. Can J Gastroenterol 2007; 21:25–9.
- Aldrete, J. A. (1995). The post-anesthesia recovery score revisited. Journal of Clinical Anesthesia, 7, 89-91.
- Chung F, Chan VW, Ong D. A post-anesthetic discharge scoring system for home readiness after ambulatory surgery. J Clin Anesth 1995; 7: 500-506.
- Palumbo P, Tellan G, Perotti B, et al. Modified PADSS (Post Anaesthetic Discharge Scoring System) for monitoring outpatients discharge. Ann Ital Chir. 2013 Nov-Dec; 84(6):661-5. PMID: 23165318






