Ендотеліїт як важливий чинник Long Covid і шляхи медикаментозної корекції
Резюме: Коронавірусну хворобу COVID-19, яка стала безпрецендетним викликом глобального масштабу, спричинює прозапальний і протромбогенний збудник – коронавірус 2 (SARS-CoV-2), інфікування яким веде до розвитку тяжкого гострого респіраторного синдрому [López Castro, 2020; Higgins et al, 2021; Østergaard, 2021].
Станом на 14 січня 2022 року, підтверджено більше 318 млн випадків захворювання на COVID-19; від хвороби померло понад 5,5 млн осіб [WHO, 2021].
Метою дослідження є систематизація та узагальнення сучасних наукових даних доказової медицини щодо особливостей Long COVID – синдрому і ролі ендотеліальної дисфункції у його розвитку.
У статті наведено сучасні наукові дані доказової медицини щодо Long COVID-синдрому і важливості ендотеліїту у його перебігу.
Ключові слова: постковідний синдром, Long COVID, ендотеліїт, L-аргінін, L-карнітин.
ВСТУП. Коронавірусну хворобу COVID-19, яка стала безпрецендетним викликом глобального масштабу, спричинює прозапальний і протромбогенний збудник – коронавірус 2 (SARS-CoV-2), інфікування яким веде до розвитку тяжкого гострого респіраторного синдрому [López Castro, 2020; Higgins et al, 2021; Østergaard, 2021]. Станом на 14 січня 2022 року, підтверджено більше 318 млн випадків захворювання на COVID-19; від хвороби померло понад 5,5 млн осіб [WHO, 2021].
COVID-19 – складне багатосистемне захворювання, симптоми якого можуть зберігатися протягом тривалого періоду часу. Даний перебіг трактується як довготривалий, або Long COVID [Cumpstey et al., 2021] та все частіше діагностується у пацієнтів.
Метою дослідження є систематизація та узагальнення сучасних наукових даних доказової медицини щодо особливостей Long COVID – синдрому і ролі ендотеліальної дисфункції у його розвитку.
МАТЕРІАЛИ І МЕТОДИ. За ключовими словами “long COVID”, “long COVID syndrome”, “COVID‑19”, “SARS-CoV-2”, “endothelitis”, “endothelial dysfunction” здійснено аналіз наукових джерел, електронних баз даних доказової медицини: Cochrane (https://www.cochrane.org/); The National Center for Biotechnology Information (https://www.ncbi.nlm.nih.gov/); Medscape from WebMD (https://www.medscape.com); Centers for Disease Control and Prevention (https://www.cdc.gov/); https://www.uptodate.com/. На сайті Національної бібліотеки України ім. В.І. Вернадського (https://www.nbuv.gov.ua/) і спеціалізованого медичного порталу Health-ua.com виконано пошук за українськими відповідниками вищезгаданих термінів. У знайдених джерелах проаналізовано усі релевантні посилання.
РЕЗУЛЬТАТИ
Long COVID: ПАТОМОРФОГЕНЕЗ І СИМПТОМИ
Встановлено, що середній час від початку захворювання до клінічного одужання при легких випадках COVID-19 становить близько 2 тижнів, а для пацієнтів з важким або критичним перебігом – 3-6 тижнів [Callard and Perego, 2021]. Довготривалий Covid-19 виникає у понад 10% усіх інфікованих пацієнтів; у них зберігаються симптоми хвороби понад 3 – 4 тижні, інколи протягом 3 – 6 місяців [COVID-19 Symptom Study App, 2020; Ladds et al., 2020; Callard and Perego, 2021]. Підтверджено високу частоту тривалих симптомів: у 87,4% госпіталізованих пацієнтів через 60 діб після початку захворювання спостерігається щонайменше один симптом [Carfi et al., 2020; Callard and Perego, 2021].
Пацієнтом з Long COVID, або ж «далекобійником» (long-hauler), згідно визначення, запропонованого Гарвардською медичною школою, вважають особу з діагнозом COVID-19, зумовленим SARSCoV‑2 і підтвердженим на основі як симптоматики, так і лабораторних досліджень, яка не повернулася упродовж 6 місяців до рівня здоров’я у передковідному періоді [Komaroff, 2021]. Пацієнти найчастіше скаржаться на втому, головний біль, задишку та аносмію [Logue et al., 2021; Sudre et al., 2021]; можуть виникати кашель, біль у серці, дисфункція периферичних нервів, когнітивні розлади [Матюха, 2021].
Стійкі ушкодження багатьох органів і систем (легень, серця, мозку, нирок та судинної системи) підтверджено у пацієнтів, які перенесли COVID‑19. Такі ураження зумовлені складними запальними реакціями, тромботичною мікроангіопатією, венозною тромбоемболією і кисневою недостатністю, які реєструвались навіть у безсимптомних пацієнтів з пневмонією, викликаною COVID-19 [Merrill et al., 2020; Bernard et al., 2021].
Основними характеристиками патоморфогенезу Long COVID-синдрому є ендотелеїт, системне фонове запалення, ураження нервової системи, пульмоніт. Потреба у розумінні механізмів захворювання, виявленні запальних процесів, пов’язаних з SARS-CoV-2, зростає, оскільки навіть через 40-60 днів після вірусної інфекції спостерігається значна запальна реакція, яка залишається у всіх пацієнтів; її можна пояснити наявністю впливу на білки імунної відповіді, пов’язані з протизапальною реакцією та мітохондріальним стресом. Це вказує на те, що біохімічні та запальні шляхи в організмі можуть залишатися порушеними протягом тривалого часу після стихання інфекції SARS-CoV-2 навіть у безсимптомних і помірно уражених пацієнтів [Doykov et al., 2020].
Діапазон симптомів SARS CoV-2 значний: від ранніх – низьких рівнів кисню в крові (гіпоксемія) без задишки («тиха гіпоксія»), марень, висипань і втрати нюху (аносмії), до стійких – болю у грудях, м’язової слабкості та болю, втоми, порушення пам’яті і утруднення концентрації уваги (“мозковий туман”), змін настрою, маніфестації артеріальної гіпертензії чи цукрового діабету [Østergaard, 2021]. Особливості патоморфогенезу та наявність важкого симптомокомплексу зумовлюють необхідність медикаментозної реабілітації лонг-ковідних пацієнтів [López Castro, 2020].
Хоча мультиорганні прояви COVID-19 на даний час задокументовано, проте залишаються недослідженими потенційні довгострокові наслідки, включно з легеневими, серцево-судинними, гематологічними, нирковими, нервовими, шлунково-кишковими та психосоціальними проявами [Higgins et al, 2021]. У когортному дослідженні [Huang et al., 2021] із залученням 1733 пацієнтів, із підтвердженим діагнозом COVID-19, яких виписано із стаціонару, вивчено довгострокові наслідки: через 6 місяців після гострої інфекції людей, які пережили COVID-19, в основному турбували втомлюваність або м’язова слабкість (63%), порушення сну (26%), тривога чи депресія (23%). Пацієнти, які хворіли важче під час перебування в лікарні, мали складніші порушення дифузійної здатності легенів й аномальні прояви при візуалізації грудної клітки.
У нещодавному огляді [Silva Andrade et al., 2021] вивчено пост- (короткочасні) та потенційні лонг-ковідні (довгострокові) наслідки; встановлено, що несприятливі осередки не є локалізованими і впливають на різні системи людини, зокрема імунну, дихальну, серцево – судинну, травну, видільну, скелетно-м’язову, нервову, а також на стан психічного здоров’я.
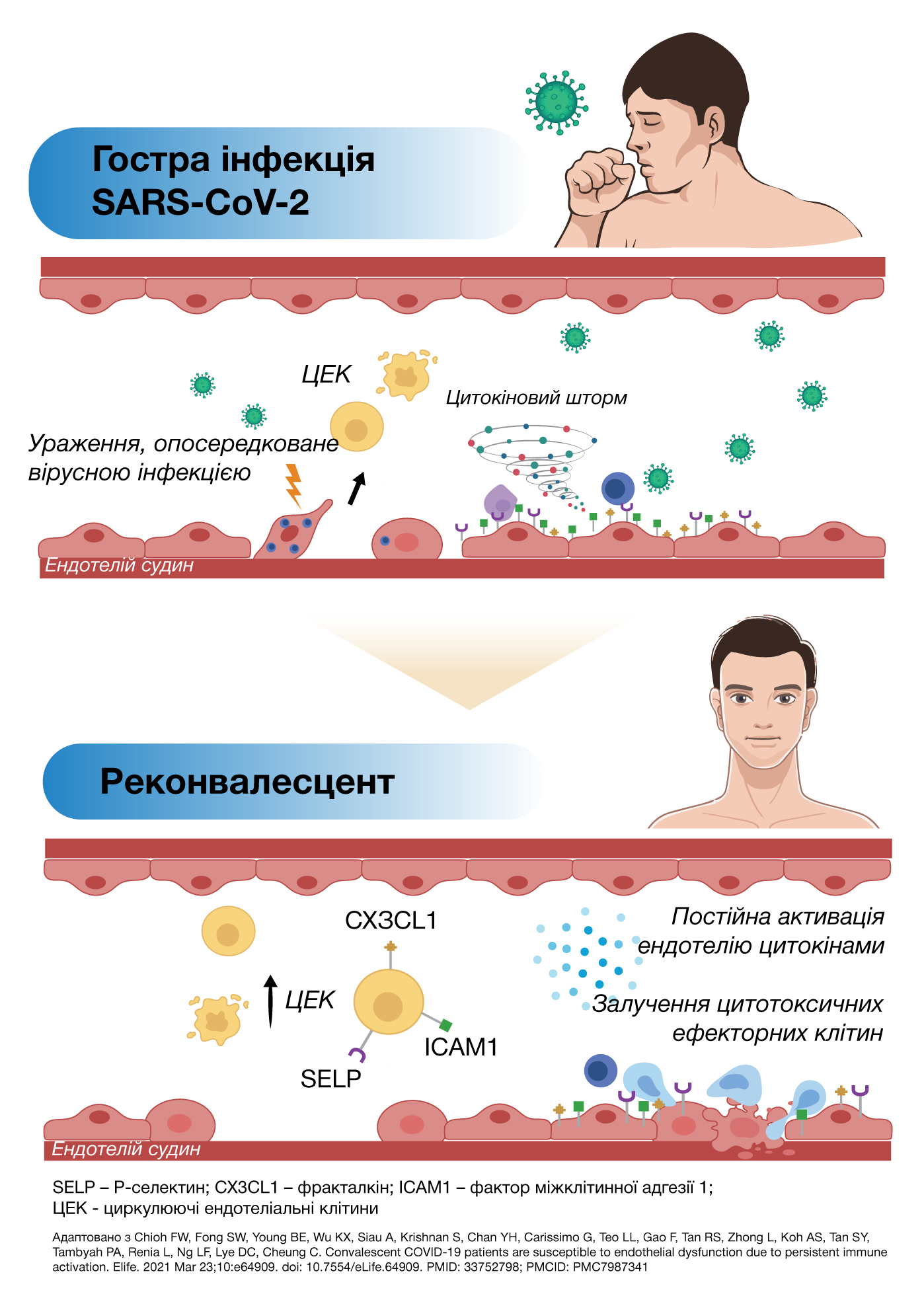
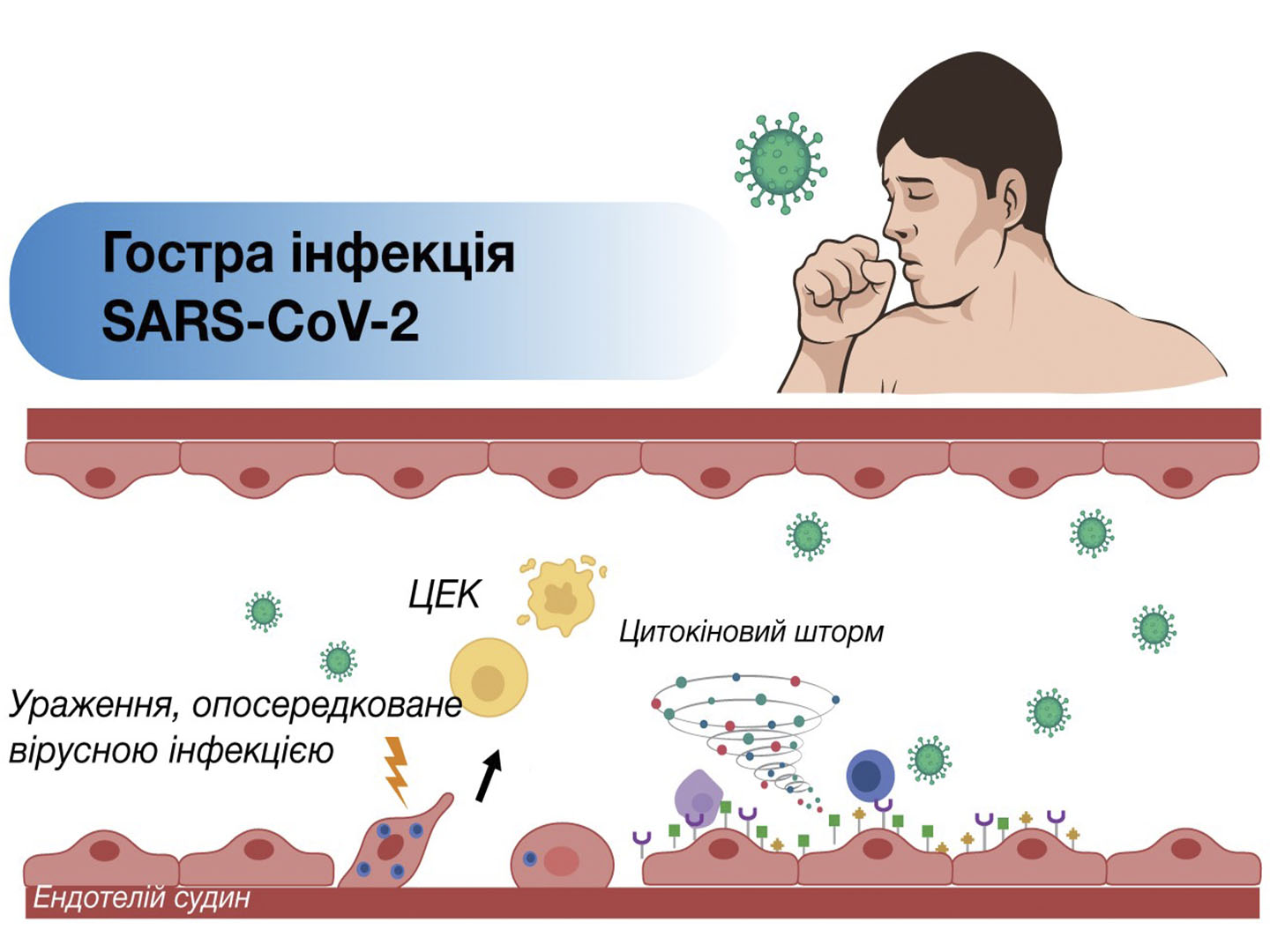
ЕНДОТЕЛІАЛЬНА ДИСФУНКЦІЯ ПРИ SARS-COV ІНФЕКЦІЇ
Патогенез COVID-19 характеризується цитокіновим штормом, який веде до ендотеліального запалення, тромбозу мікросудин та порушення функціонування багатьох органів [Silva Andrade et al., 2021]. SARS-CoV-2 впливає на мікроциркуляцію, викликаючи набряк і пошкодження ендотеліальних клітин (ендотеліт), формування мікроскопічних згустків крові (мікротромбоз), порушення кровообігу у капілярах та пошкодження перицитів, що порушує капілярну цілісність і бар’єрну функцію, відновлення тканин (ангіогенез) [Ackermann et al., 2020; Østergaard, 2021] і формування рубців. Порушення структури капілярів і запалення можуть сприяти виникненню гострих і постійних симптомів COVID-19, перешкоджаючи належному функціонуванню мозку, оксигенації крові й тканин [Østergaard, 2021].
Мішенями SARS-CoV-2 є також імунні органи та дрібні системні судини, що веде до системного васкуліту й зниження імунної функції. Інші рецептори на поверхні клітин людини (трансмембранна серинова протеаза 2, сіалова кислота, індуктор металопротеїнази позаклітинного матриксу CD147), можливо, сприяють проникненню SARS-CoV-2 [Huertas et al., 2020]. АПФ-2, як інші три вищезгадані рецептори, наявні на артеріальних і венозних ендотеліальних клітинах та клітинах гладеньких м’язів артерій [Hamming et al., 2004]. Інтерлейкін-6 (ІL-6), який продукується під час синдрому цитокінової бурі, також може індукуватись ангіотензином II внаслідок механізму, опосередкованого рецепторами мінералокортикоїдів [Luther et al., 2006; Guzik et al., 2020].
Системна гіпертензія, діабет та ожиріння, на тлі яких дисфункція ендотелію стає вирішальним чинником, є найбільш поширеними супутніми патологіями, асоційованими з гіршим прогнозом і вищим рівнем смертності у пацієнтів із COVID-19 [Huertas et al., 2018].
SARS-CoV-2, як й інші інфекційні збудники, унаслідок запальних реакцій, може активувати коагулопатію. Запальний ефект цитокінів активує ендотеліальні клітини судин і пошкодження ендотелію, що викликає протромботичну дію. Пошкодження судинного ендотелію може призводити до тромбоцитопенії, зменшення вмісту природних антикоагулянтів, гемостатичної активації як фенотипового прояву дифузної тромботичної внутрішньосудинної коагуляції [Huertas et al., 2020].
Після перенесеного COVID‑19 у пацієнтів, внаслідок ушкодження ендотелію судин, на 25% зростає ризик тромбоемболії, виникає спазм судин. Як результат ураження міокарда, у лонгковідних пацієнтів наявні аритмії, ризик інфарктів зростає на 22%, у міокарді виникають порушення перфузії та ішемічні зміни [Коваленко, 2020].
ЕКСПРЕСІЯ ЕПІТЕЛІАЛЬНИХ РЕЦЕПТОРІВ АПФ-2 ЯК ПРОВІДНИЙ МЕХАНІЗМ ПРИ УРАЖЕННІ SARS-CoV-2
Експресія АПФ-2 на ендотеліальних клітинах, клітинах гладенької мускулатури та периваскулярних перицитах практично в усіх органах свідчить про те, що SARS-CoV-2 може значно поширюватися в організмі [Hamming et al., 2004]. АПФ-2 є геном, який стимулюється людським інтерфероном, тому SARS-CoV-2 при ураженні тканини легень може видоспецифічно за посередництвом даного гена стимулювати експресію тканинно-захисного медіатора – АПФ-2 [Ziegler et al., 2020].
Патогенетичні механізми також залежать від локалізації ко-рецепторів коронавірусу: високим вмістом АПФ-2 характеризуються епітеліальні клітини легень і тонкої кишки людини, які саме контактують із довкіллям і тому можуть стати вхідними воротами для збудника. Епітеліальною експресією можна пояснити патогенез головних проявів SARS, зокрема у легенях (кашель, пневмонія, тяжкий гострий респіраторний синдром). АПФ-2 значно експресується пневмоцитами I і II типу, що вказує на альвеолярні пневмоцити як можливе місце проникнення для SARS-CoV-2 [Hamming et al., 2004]. У випадку SARS значна експресія АПФ-2 в альвеолярних клітинах II типу може спровокувати швидке поширення інфекційного агента, розвиток прогресуючого тяжкого дифузного ушкодження альвеол і гіперзапального процесу – «цитокінового шторму» [Huertas et al., 2020; Mehta et al., 2020].
Додатково до дифузного пошкодження альвеол із периваскулярною Т-клітинною інфільтрацією і поширеного тромбозу з мікроангіопатією характерними ознаками судин у пацієнтів із COVID-19 є значне ураження ендотелію, зумовлене наявністю вірусу в клітинах і пошкодженням клітинних мембран, а також порушення ангіогенезу [Ackermann et al., 2020]. Для АПФ-2 доведено роль у підтримці ендотеліальної цілісності всередині судин [Kumar et al., 2020].
Клітини ендотелію є основними регуляторами запалення, і оскільки тромботичні явища тісно пов’язані із запальним процесом, для усунення наслідків COVID-19 призначають терапевтичні агенти, які здатні модулювати механізми запалення, ендотеліальну дисфункцію та прооксидантний стрес [Pober and Sessa, 2007]. Залучення у процес ендотелій-асоційованих моноцитів може сприяти індукції імунотромбозу [McFadyen et al., 2020; Bonaventura et al., 2021]. Для запобігання ендотеліальної дисфункції і агрегації тромбоцитів організмом продукується ектонуклеотидаза CD39, яка запобігає АДФ-опосередкованій активації тромбоцитів, вивільненню NO та простацикліну [Hamilos et al., 2018; Zahran et al., 2021].
У реконвалесцентів COVID-19, порівняно із здоровими особами, спостерігається підвищений рівень циркулюючих ендотеліальних клітин (ЦЕК), що є біомаркерами судинного ушкодження. Пацієнти з попередньо наявними захворюваннями (гіпертонією, діабетом тощо) мали більш виражені ознаки активації ендотелію, порівняно із пацієнтами без COVID-19, у яких були серцево-судинні ризики. Декілька прозапальних та активованих цитокінів, асоційованих з Т-лімфоцитами, наявні від фази гострої інфекції до періоду одужання, що позитивно корелює із вмістом ЦЕК, підтверджучи залучення цитокінів у розвиток ендотеліальної дисфункції. Ефекторні Т-клітини виявляють частіше у реконвалесцентів COVID-19, порівняно зі здоровими особами. Маркери активації, виявлені на ЦЕК, містяться переважно на CD8+ Т- цитотоксичних клітинах, підвищуючи можливість таргетування активованих ендотеліальних клітин [Chioh et al., 2021].
Навіть при відсутності вірусу в організмі, що можна продемонструвати повторними негативними ПЛР-тестами, прозапальний та протромботичний стан на ендотеліальному рівні мікросудин у частини пацієнтів все ж залишається, що веде до хронічного реактивного ендотеліїту з дисемінованим ураженням судин [López Castro, 2020]. Fogarty H. та співавтори у нещодавній публікації висловлюють думку, що саме ендотеліїт, який зберігається після гострої фази, стає однією із головних причин клінічних симптомів Long COVID [Fogarty et al., 2021].
ШЛЯХИ МЕДИКАМЕНТОЗНОЇ КОРЕКЦІЇ ЕНДОТЕЛІЇТУ У ПАЦІЄНТІВ З LONG COVID
L-аргінін – амінокислота, яка бере участь у багатьох біологічних процесах, зокрема біосинтезі білків, імунній відповіді, продукуванні оксиду азоту. Важливу функціональну роль L-аргінін відіграє в регуляції ендотеліальної функції та тонусу судин, сприянні відновленню структури ендотелію легеневих артерій, оскільки є субстратом для вироблення NO ендотеліальними клітинами [Wu et al., 2009; Luiking et al., 2012; Gambardella et al., 2020; Zhang et al., 2020].
Ізоензимам NO-синтази (NOS) відводиться важлива роль в утворенні L-аргініну з оксиду азоту. Існує три ізоформи NOS, дві з яких – ендотеліальна (eNOS) і нейрональна (nNOS) – конститутивно (постійно) експресуються, а третя, індуцибельна NOS (iNOS), експресується у відповідь на дію цитокінів і є пов’язаною із запальною реакцією. Генерація NO відбувається у два етапи: на першому NOS гідроксилює аргінін до Nw-гідрокси-аргініну, який залишається значною мірою пов’язаним з ферментом; на другому етапі NOS окислює утворений Nw-гідрокси-аргінін до цитруліну та NO. За фізіологічних умов NOS каталізує перетворення аргініну, О2 та НАДФН-похідних електронів до NO та цитруліну. Однак при наявності таких патологічних станів, як атеросклероз і цукровий діабет, функція NOS змінюється, і фермент каталізує відновлення O2 до супероксиду (O2–), – це явище, яке зазвичай називають «роз’єднанням NOS», пов’язане з обмеженою біодоступністю тетрагідробіоптерину (BH4, відомого як сапроптерин). Для окислення аргініну до цитруліну необхідний перехід електрона від BH4 з утворенням тимчасового радикалу BH4•+ і пов’язаного з цим комплексу Fe2+-NO у каталітичному центрі гему NOS. BH4 синтезується з гуанозинтрифосфату (GTP) за участю GTP-циклогідролази I (GTPCH) і рециклізується з 7,8-дигідробіоптерину (BH2) за допомогою дигідрофолатредуктази. NOS інгібується аналогами аргініну, які заміщені по атому Нітрогену гуанідину, наприклад NG-монометил-аргініном або NG-нітро-аргініном [Gambardella et al., 2020].
Введення аргінінвмісних засобів в організм пацієнтів з COVID-19 у сучасних умовах розглядається як патогенетично обгрунтований терапевтичний підхід для корекції ендотеліїту [Wu et al., 2009; Luiking et al., 2012; Gambardella et al., 2020; Zhang et al., 2020].
Слід зауважити, що з двох ізомерів аргініну фізіологічно активним є лише лівообертальний (L-аргінін), який входить до складу білків ссавців; D-аргінін характеризується низькою біодоступністю [Wu et al., 2009; Aso et al., 2020]. Рослинне походження L-аргініну, активної субстанції інфузійного лікарського засобу Тівортін, є вагомою перевагою у порівнянні з іншими аналогами: відомо, що призначення L-аргініну рослинного походження чинить протекторний вплив, сприяє покращенню артеріального тиску. L-аргінін ж тваринного походження може бути чинником ризику розвитку артеріальної гіпертензії та ішемічної хвороби серця, порушувати ліпідний профіль, підвищувати діастолічний тиск [Bahadoran et al., 2016].
Long COVID може приховуватись під різними фенотипами (масками) на фоні загострення перебігу цукрового діабету, ожиріння, гіпертензивного кризу, аритмій, набряків нижніх кінцівок [Deer et al., 2021]. Розвиток ураження міокарду пацієнтів зумовлене впливом цитокінів, а не безпосередньо збудником [Thakkar et al., 2020]. Сполука природного походження левокарнітин (L-карнітин), що входить до складу лікарського засобу ТІВОРЕЛЬ, забезпечує імуномодулювальний ефект шляхом пригнічення прозапальних цитокінів при «цитокіновому штормі»; тому L-карнітин вважають важливим чинником у лікуванні гострих станів, зокрема сепсису і пневмонії у лонгковідних пацієнтів [Коваленко, 2020; Pagano et al., 2021].
Вітчизняними науковцями-клініцистами [Курята і Гречаник, 2019; Галушко, 2021; Матюха, 2021] запропоновано наступні схеми лікування, якими доцільно послуговуватись у пацієнтів із Long COVID: Тіворель (L-карнітин + L-аргінін) протягом 14 діб по 1 фл. (100 мл) 1 раз на добу довенно крапельно. Після цього слід продовжити відновлення судин шляхом призначення препарату Тівортін аспартат – по 2 мірні ложки внутрішньо, 2 рази на добу, до 2 місяців.
Автор: Нетяженко Василь Захарович, д.мед.н., професор, член-кореспондент НАМН України, завідувач кафедри пропедевтики внутрішньої медицини № 1 Національного медичного університету ім. О.О. Богомольця.
Висновки:
У статті наведено сучасні наукові дані доказової медицини щодо Long COVID- синдрому і важливості ендотеліїту у його перебігу.
Враховуючи етіопатологічні механізми розвитку ендотеліальної дисфункції при коронавірусній інфекції, дані щодо можливих віддалених наслідків хвороби і здатність Long COVID приховуватись під різними фенотипами (масками) на фоні загострення перебігу інших супутніх захворювань і станів, слід зважати на розвиток наявного або потенційного хронічного реактивного ендотеліїту та враховувати при виборі синдромно-патогенетичної терапії для лікування пацієнтів, які перенесли COVID-19.
Обгрунтовано доцільність призначення інфузійних препаратів на основі амінокислот – L-аргініну рослинного походження і L-карнітину (Тіворель, Тівортін аспартат) – пацієнтам синдромом Long COVID.
Література:
- Ackermann M, Verleden SE, Kuehnel M, et al. . Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med2020; 383: 120–128.
- Aso K, Nishigawa T, Nagamachi S, Takakura M, Furuse M. Orally administrated D-arginine exhibits higher enrichment in the brain and milk than L-arginine in ICR mice. J Vet Med Sci. 2020 Mar 5;82(3):307-313. doi: 10.1292/jvms.19-0630
- Bahadoran Z, Mirmiran P, Tahmasebinejad Z, Azizi F. Dietary L-arginine intake and the incidence of coronary heart disease: Tehran lipid and glucose study. Nutr Metab (Lond). 2016 Mar 15;13:23. doi: 10.1186/s12986-016-0084-z.
- Bernard I, Limonta D, Mahal LK, Hobman TC. Endothelium Infection and Dysregulation by SARS-CoV-2: Evidence and Caveats in COVID-19. Viruses. 2021; 13(1):29. https://doi.org/10.3390/v13010029
- Bonaventura A, Vecchié A, Dagna L, Martinod K, Dixon DL, Van Tassell BW, Dentali F, Montecucco F, Massberg S, Levi M, Abbate A (2021). Endothelial dysfunction and immunothrombosis as key pathogenic mechanisms in COVID-19. Nat Rev Immunol. 21(5), 319-329
- Callard F, Perego E. How and why patients made Long Covid. Soc Sci Med. 2021 Jan;268:113426. doi: 10.1016/j.socscimed.2020.113426
- Carfì A, Bernabei R, Landi F; Gemelli Against COVID-19 Post-Acute Care Study Group. Persistent Symptoms in Patients After Acute COVID-19. JAMA. 2020 Aug 11;324(6):603-605. doi: 10.1001/jama.2020.12603
- Chioh FW, Fong SW, Young BE, Wu KX, Siau A, Krishnan S, Chan YH, Carissimo G, Teo LL, Gao F, Tan RS, Zhong L, Koh AS, Tan SY, Tambyah PA, Renia L, Ng LF, Lye DC, Cheung C. Convalescent COVID-19 patients are susceptible to endothelial dysfunction due to persistent immune activation. Elife. 2021 Mar 23;10:e64909. doi: 10.7554/eLife.64909
- COVID-19 Symptom Study App, 2020. How Long Does COVID-19 Last-. Доступ: 14 вересня 2021. https://covid.joinzoe.com/post/covid-long-term.
- Cumpstey AF, Clark AD, Santolini J, Jackson AA, Feelisch M. COVID-19: A Redox Disease-What a Stress Pandemic Can Teach Us About Resilience and What We May Learn from the Reactive Species Interactome About Its Treatment. Antioxid Redox Signal. 2021 Jun 29. doi: 10.1089/ars.2021.0017.
- Deer R.R., Rock M.A., Vasilevsky N. et al. (2021) Characterizing Long COVID: Deep Phenotype of a Complex Condition. medRxiv, June 29. doi.org/10.1101/2021.06.23.21259416.
- Doykov I, Hällqvist J, Gilmour KC, Grandjean L, Mills K, Heywood WE. ‘The long tail of Covid-19’ – The detection of a prolonged inflammatory response after a SARS-CoV-2 infection in asymptomatic and mildly affected patients. F1000Res. 2020 Nov 19;9:1349. doi: 10.12688/f1000research.27287.2
- Fogarty H, Townsend L, Morrin H, Ahmad A, Comerford C, Karampini E, et al. Persistent endotheliopathy in the pathogenesis of long COVID syndrome. J Thromb Haemost. 2021 Aug 10:10.1111/jth.15490. doi: 10.1111/jth.15490
- Gambardella J, Khondkar W, Morelli MB, Wang X, Santulli G, Trimarco V. Arginine and Endothelial Function. Biomedicines. 2020 Aug 6;8(8):277. doi: 10.3390/biomedicines8080277.
- Guzik TJ, Mohiddin SA, Dimarco A, et al. . COVID-19 and the cardiovascular system: implications for risk assessment, diagnosis, and treatment options. Cardiovasc Res2020; in press [10.1093/cvr/cvaa106].
- Hamilos M, Petousis S, Parthenakis F. (2018) Interaction between platelets and endothelium: from pathophysiology to new therapeutic options. Cardiovasc Diagn Ther. 8(5), 568-580
- Hamming I, Timens W, Bulthuis ML, et al. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol2004; 203: 631–637. doi:10.1002/path.1570
- Higgins V, Sohaei D, Diamandis EP, Prassas I. COVID-19: from an acute to chronic disease- Potential long-term health consequences. Crit Rev Clin Lab Sci. 2021 Aug;58(5):297-310. doi: 10.1080/10408363.2020.1860895
- Huang C, Huang L, Wang Y, Li X, Ren L, Gu X, Kang L, Guo L, Liu M, Zhou X, Luo J, Huang Z, Tu S, Zhao Y, Chen L, Xu D, Li Y, Li C, Peng L, Li Y, Xie W, Cui D, Shang L, Fan G, Xu J, Wang G, Wang Y, Zhong J, Wang C, Wang J, Zhang D, Cao B. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet. 2021 Jan 16;397(10270):220-232. doi: 10.1016/S0140-6736(20)32656-
- Huertas A, Guignabert C, Barbera JA, et al. . Pulmonary vascular endothelium: the orchestra conductor in respiratory diseases: highlights from basic research to therapy. Eur Respir J2018; 51: 1700745. doi:10.1183/13993003.00745-2017
- Huertas A, Montani D, Savale L, Pichon J, Tu L, Parent F, Guignabert C, Humbert M. Endothelial cell dysfunction: a major player in SARS-CoV-2 infection (COVID-19)? Eur Respir J. 2020 Jul 30;56(1):2001634. doi: 10.1183/13993003.01634-2020
- Komaroff A.. The tragedy of the post-COVID “long haulers”. March 01, 2021. https://www.health.harvard.edu/blog/the-tragedy-of-the-post-covid-long-haulers-2020101521173
- Kumar A, Narayan RK, Kumari C, Faiq MA, Kulandhasamy M, Kant K, Pareek V. SARS-CoV-2 cell entry receptor ACE2 mediated endothelial dysfunction leads to vascular thrombosis in COVID-19 patients. Med Hypotheses. 2020 Dec;145:110320. doi: 10.1016/j.mehy.2020.110320
- Ladds E, Rushforth A, Wieringa S, Taylor S, Rayner C, Husain L, Greenhalgh T. Persistent symptoms after Covid-19: qualitative study of 114 “long Covid” patients and draft quality principles for services. BMC Health Serv Res. 2020 Dec 20;20(1):1144. doi: 10.1186/s12913-020-06001-y
- Logue JK, Franko NM, McCulloch DJ, McDonald D, Magedson A, Wolf CR, Chu HY. Sequelae in Adults at 6 Months After COVID-19 Infection. JAMA Netw Open. 2021 Feb 1;4(2):e210830. doi: 10.1001/jamanetworkopen.2021.0830. Erratum in: JAMA Netw Open. 2021 Mar 1;4(3):e214572
- López Castro J. Post-COVID-19 Syndrome (PC19S): Chronic Reactive Endotheliitis and Disseminated Vascular Disease. Acta Med Port. 2020 Dec 2;33(12):859. doi: 10.20344/amp.14612
- Luiking Y.C., Ten Have G.A., Wolfe R.R., Deutz N.E. Arginine de novo and nitric oxide production in disease states. J. Physiol. Endocrinol. Metab. 2012;303:E1177–E1189. doi: 10.1152/ajpendo.00284.2012
- Luther JM, Gainer JV, Murphey LJ, et al. . Angiotensin II induces interleukin-6 in humans through a mineralocorticoid receptor-dependent mechanism. Hypertension2006; 48: 1050–1057. doi:10.1161/01.HYP.0000248135.97380.76
- McFadyen JD, Stevens H, Peter K. The Emerging Threat of (Micro)Thrombosis in COVID-19 and Its Therapeutic Implications. Circ Res. 2020 Jul 31;127(4):571-587. doi: 10.1161/CIRCRESAHA.120.317447.
- Mehta P, McAuley DF, Brown M, et al. . COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet2020; 395: 1033–1034. doi:10.1016/S0140-6736(20)30628-0
- Merrill, J.T., Erkan, D., Winakur, J. et al.Emerging evidence of a COVID-19 thrombotic syndrome has treatment implications. Nat Rev Rheumatol 16, 581–589 (2020). https://doi.org/10.1038/s41584-020-0474-5
- Østergaard L. SARS CoV-2 related microvascular damage and symptoms during and after COVID-19: Consequences of capillary transit-time changes, tissue hypoxia and inflammation. Physiol Rep. 2021 Feb;9(3):e14726. doi: 10.14814/phy2.14726
- Pagano G, Manfredi C, Pallardó FV, Lyakhovich A, Tiano L, Trifuoggi M. Potential roles of mitochondrial cofactors in the adjuvant mitigation of proinflammatory acute infections, as in the case of sepsis and COVID-19 pneumonia. Inflamm Res. 2021 Feb;70(2):159-170. doi: 10.1007/s00011-020-01423-0
- Pober JS, Sessa WC (2007). Evolving functions of endothelial cells in inflammation. Nat Rev Immunol. 7(10), 803-15.
- Silva Andrade B, Siqueira S, de Assis Soares WR, de Souza Rangel F, Santos NO, Dos Santos Freitas A, Ribeiro da Silveira P, Tiwari S, Alzahrani KJ, Góes-Neto A, Azevedo V, Ghosh P, Barh D. Long-COVID and Post-COVID Health Complications: An Up-to-Date Review on Clinical Conditions and Their Possible Molecular Mechanisms. Viruses. 2021 Apr 18;13(4):700. doi: 10.3390/v13040700
- Sudre CH, Murray B, Varsavsky T, Graham MS, Penfold RS, Bowyer RC, et al. Attributes and predictors of long COVID. Nat Med. 2021 Apr;27(4):626-631. doi: 10.1038/s41591-021-01292-y.
- Thakkar S., Arora S., Kumar A. et al. (2020) A Systematic Review of the Cardiovascular Manifestations and Outcomes in the Setting of Coronavirus-19 Disease. Clin. Med. Insights. Cardiol.; 14: 1179546820977196
- WHO, 2021. Coronavirus disease (COVID-19) pandemic https://www.who.int/emergencies/diseases/novel-coronavirus-2019. Доступно 01-12-2021
- Wu G, Bazer FW, Davis TA, Kim SW, Li P, Marc Rhoads J, Carey Satterfield M, Smith SB, Spencer TE, Yin Y. Arginine metabolism and nutrition in growth, health and disease. Amino Acids. 2009 May;37(1):153-68. doi: 10.1007/s00726-008-0210-y.
- Zahran AM, El-Badawy O, Ali WA, Mahran ZG, Mahran EEMO, Rayan A (2021). Circulating microparticles and activated platelets as novel prognostic biomarkers in COVID-19; relation to cancer. PLoS One. 2021 Feb 22;16(2):e0246806.
- Zhang W., Zhao Y., Zhang F. The use of anti-inflammatory drugs in the treatment of people with severe coronavirus disease 2019 (COVID-19): The Perspectives of clinical immunologists from China. Clinical Immunology. 2020; 214: 108393.
- Ziegler CGK, Allon SJ, Nyquist SK, et al. . SARS-CoV-2 receptor ACE2 is an interferon-stimulated gene in human airway epithelial cells and is detected in specific cell subsets across tissues. Cell2020; 181: 1016–1035. doi:10.1016/j.cell.2020.04.035
- Галушко О.А. Астенічний синдром у постковідного пацієнта. Медична газета «Здоров’я України 21 століття» №6 (499), 2021 р.
- Коваленко С.В. Досвід застосування методів синдромно-патогенетич¬ної терапії при пневмонії, спричиненій COVID-19, в умовах пульмоно¬логічного відділення. Медична газета «Здоров’я України 21 сторіччя» № 13-14 (481-482), 2020 р.
- Курята, М. М. Гречаник. Роль L-аргініну в лікуванні серцево-судинних захворювань: у фокусі – вибір ефективної дози. О.В. Медична газета “Здоров’я України”, No11 (456), 2019 р.
- Матюха Л.Ф. «Далекобійники»: пацієнти з постковідним синдромом у рутинній клінічній практиці. Журнал «Здоров’я України» №4, 2021.





