Модуляція енергетичної гнучкості міокарда – новий шлях поліпшення лікування ішемічної хвороби серця

Ішемічна хвороба серця (ІХС) – кардіологічна патологія, що характеризується порушенням кровотоку в серцевому м’язі внаслідок ураження коронарних судин. ІХС являє собою одне із найпоширеніших захворювань у світі, яке нерідко призводить до виникнення тяжких ускладнень, інвалідизації та погіршення якості життя пацієнтів. Головна загроза усіх серцевосудинних патологій – це раптова серцева смерть.
 Згідно із даними British Heart Foundation (2024), хвороби серця та системи кровообігу є причиною 1 із 3 смертей у всьому світі. Близько 50% усіх летальних випадків через кардіоваскулярні події асоційовані з раптовою серцевою смертю, половина з яких – перший прояв кардіальної патології.
Згідно із даними British Heart Foundation (2024), хвороби серця та системи кровообігу є причиною 1 із 3 смертей у всьому світі. Близько 50% усіх летальних випадків через кардіоваскулярні події асоційовані з раптовою серцевою смертю, половина з яких – перший прояв кардіальної патології.
Аналіз даних Українського центру суспільних даних (2019) показав, що в нашій країні смертність через хвороби системи кровообігу становить 67% усіх летальних випадків, серед яких на частку атеросклеротичних захворювань серця припадає 35%. Очікується, що глобальна кількість смертей від патологій серця та кровообігу надалі продовжить зростати.
ІХС – складне хронічне захворювання, що характеризується ремоделюванням і звуженням коронарних артерій, які постачають кисень до серця (SayolsBaixeras, 2014). Нормальна серцева функція залежить від постійного ресинтезу аденозинтрифосфату (АТФ) шляхом окисного фосфорилювання в мітохондріях. Здорове серце отримує 60‑90% енергії для окисного фосфорилювання за рахунок окислення жирних кислот (ЖК) (Stanley, Chandler, 2002). Порушення мітохондріальної функції та окисного фосфорилювання може знизити серцеву функцію через недостатнє постачання АТФ до кардіоміоцитів.
В умовах ішемії знижуються перфузія тканин та доставка кисню, що викликає:
- інтенсивне утворення й накопичення активних форм кисню та вільних радикалів;
- пошкодження мітохондрій.
ЖК, які не потрапили до мітохондрій, накопичуються в цитозолі, де активують процеси перекисного окиснення ліпідів, що призводить до ушкодження та загибелі клітин міокарда. Зменшення постачання АТФ посилює окислювальний стрес міокарда й у поєднанні з ендотеліїтом та ендотеліальною дисфункцією зумовлює прогресування ІХС і погіршення стану пацієнта.
Основною особливістю серця є його метаболічна гнучкість, а саме здатність серця використовувати різні джерела енергії в умовах ішемії, якот жирні кислоти, глюкоза, лактат, кетони та амінокислоти (Neubauer, 2007). Це дозволяє йому ефективно забезпечувати енергією тканини у разі підвищеної потреби за допомогою складної мережі взаємодіючих метаболічних шляхів із залученням кожного класу енергетичного субстрату (Saddik, 1991). Оскільки функція серця тісно пов’язана з його метаболізмом, зміни в метаболічних шляхах можуть призводити до морфологічних і функціональних змін.
В умовах ішемії важливо забезпечити міокард достатньою кількістю АТФ. Під час інтенсивного навантаження або гіпоксії серце збільшує споживання глюкози та зменшує споживання ЖК, оскільки для виробництва АТФ із глюкози потрібно менше кисню, ніж АТФ із ЖК. Але утворення АТФ із ЖК є енергетично вигіднішим, тому бажано, щоб клітини в неішемізованих зонах міокарда отримували АТФ саме цим шляхом.
З огляду на ферменти, відповідальні за окислення ЖК, існує багато метаболічних цілей, які є перспективними для оптимізації та збалансування енергетичної гнучкості міокарда, щоб запобігти небажаним ефектам ішемії. Хоча на даний час не існує ефективних стимуляторів окисного фосфорилювання, було показано, що окремі препарати опосередковано поліпшують захист серця від окисного стресу. Провідним лікарським засобом із такою функцією є Тіворель Аспартат (фармацевтична компанія «ЮріяФарм», Україна).
За рахунок двох амінокислот у його складі – Lкарнітину та Lаргініну – забезпечуються такі ефекти препарату:
- антигіпоксичний;
- цитопротекторний;
- антиоксидантний;
- дезінтоксикаційний;
- мембраностабілізувальний.
Lкарнітин – це природна складова клітин організму людини. Ендогенний Lкарнітин синтезується в мозку, нирках, печінці з двох амінокислот: Lлізину та Lметіоніну. Найбільше Lкарнітину містять міокард та скелетні м’язи, які не здатні до його продукції, але отримують Lкарнітин із плазми крові.
Lкарнітин виконує функції антигіпоксанта за рахунок своєї фундаментальної ролі у процесах виробництва клітинної енергії шляхом транспортування в мітохондрії довголанцюгових ЖК (із подальшим їх розпадом у процесі βокиснення до ацетилкоензиму А, що є субстратом для синтезу АТФ у циклі Кребса). Цей процес можливий виключно за участю Lкарнітину. Його недостатність прямо корелює зі зменшенням вмісту ацетилкоензиму А та порушеннями усіх видів енергетичного обміну. За ішемії концентрація Lкарнітину в міокарді різко знижується, тому для підтримання нормальної роботи серця, забезпечення достатньої кількості АТФ та правильного ритму необхідне призначення Lкарнітину вже в ранньому періоді клінічних проявів ІХС.
Новітні дослідження підтверджують, що Lкарнітин чинить протекторну дію, захищаючи клітини серця від гіпоксії, ішемії та окисного стресу (Alhasaniah, 2023). Метааналіз J.J. DiNicolantonio et al. (2013) показав, що раннє використання Lкарнітину в пацієнтів із гострим інфарктом міокарда достовірно зменшує смертність від будьяких причин на 27%. Ризик розвитку шлуночкової артимії та стенокардії знижується на 65 та 40% відповідно.
З огляду на позитивний вплив Lкарнітину на порушення ритму серця, рада експертів Асоціації аритмологів України під час свого засідання прийняла рішення, що застосування фіксованої комбінації Lаргініну та Lкарнітину, які входять до складу препарату Тіворель Аспартат, є патогенетично обґрунтованим лікуванням осіб з ІХС та шлуночковими аритміями. Така терапія сприяє достовірному зниженню частоти шлуночкових порушень ритму та атріовентрикулярних блокад.
Інший компонент препарату Тіворель Аспартат Lаргінін – умовно незамінна амінокислота, яка є попередником для синтезу багатьох біологічно важливих молекул. Основна роль аргініну в організмі людини полягає в тому, що це субстрат для утворення оксиду азоту (NO), який є важливим фактором підтримки судинного гомеостазу. Він бере участь у регуляції судинного тонусу, оксидантних процесів, проліферації та апоптозу. Фізіологічна потреба людини в Lаргініні за звичайних умов покривається за рахунок його ендогенного синтезу в організмі. Однак потреби у цій амінокислоті зростають на тлі навантаження, стресу, травм або різних захворювань незалежно від віку, і тоді Lаргінін стає незамінним. Зниження концентрації та доступності Lаргініну і NO є ключовою патофізіологічною ланкою виникнення ендотеліальної дисфункції.
В умовах ішемії Lаргінін розширює спазмовані судини та сприяє відновленню кровообігу і доставки кисню до клітин. У складі препарату Тіворель Аспартат Lаргінін виконує функцію ендотеліопротектора – відновлює функцію ендотелію і компенсує дефіцит NO, пригнічує ендотеліїт та гальмує атерогенез. Окрім того, Lаргінін має широкий спектр біологічних властивостей, проявляючи антигіпоксичну, антиоксидантну та дезінтоксикаційну активність, є активним регулятором пластичного й енергетичного обмінів, імунних і метаболічних процесів (Almakaeva, 2011; Ganz, 2016).
Взаємодія Lкарнітину та Lаргініну в організмі відбувається на рівні фармакодинамічних реакцій і проявляється у вигляді потенціювання кардіопротекторної дії Lаргініну. Як донатор NO, Lаргінін у складі препарату Тіворель Аспартат:
- Бере участь у процесах енергозабезпечення організму.
- Зменшує активацію та адгезію лейкоцитів і тромбоцитів до ендотелію судин.
- Запобігає утворенню й розвитку атеросклеротичних бляшок.
Тіворель Аспартат – це єдина комбінація, що діє на декілька ланок патогенезу розвитку гіпоксії та стимулює серце ефективно використовувати різні джерела енергії.
Результати вітчизняного дослідження підтверджують ефективність застосування лікарського засобу Тіворель® у складі комплексної терапії ІХС. Було проведене рандомізоване відкрите порівняльне паралельне дослідження за участю 110 пацієнтів віком 45‑75 років із підтвердженим діагнозом ІХС, верифікованим за допомогою коронаровентрикулографії та навантажувальних проб або за наявністю постінфарктного кардіосклерозу.
Хворих рандомізували до груп стандартної терапії (контрольна група) та її комбінації з Тіворелем. Головним критерієм ефективності було визначено зміну тривалості виконуваного фізичного навантаження при проведенні навантажувальної проби (тредмілтесту) за протоколом R. Bruce після 21денного курсу лікування у популяції РР (пацієнти, які повністю виконали протокол дослідження).
Отримані результати свідчать, що застосування Тіворелю достовірно поліпшує тривалість виконуваного фізичного навантаження на тредмілі (рис. 1). Після 21денного курсу лікування порівняно з початковими даними показник у групі Тіворелю склав 0,87±1,21 хв, у контрольній – 0,28±1,30 хв. Відносне збільшення часу фізичного навантаження в основній групі було 23,89±39,27%, а в контрольній – 8,29±25,49%. Це дозволяє дійти висновків, що застосування препарату Тіворель® на тлі стандартної терапії перевищує ефективність застосування лише стандартного лікування щодо тривалості виконуваного фізичного навантаження.
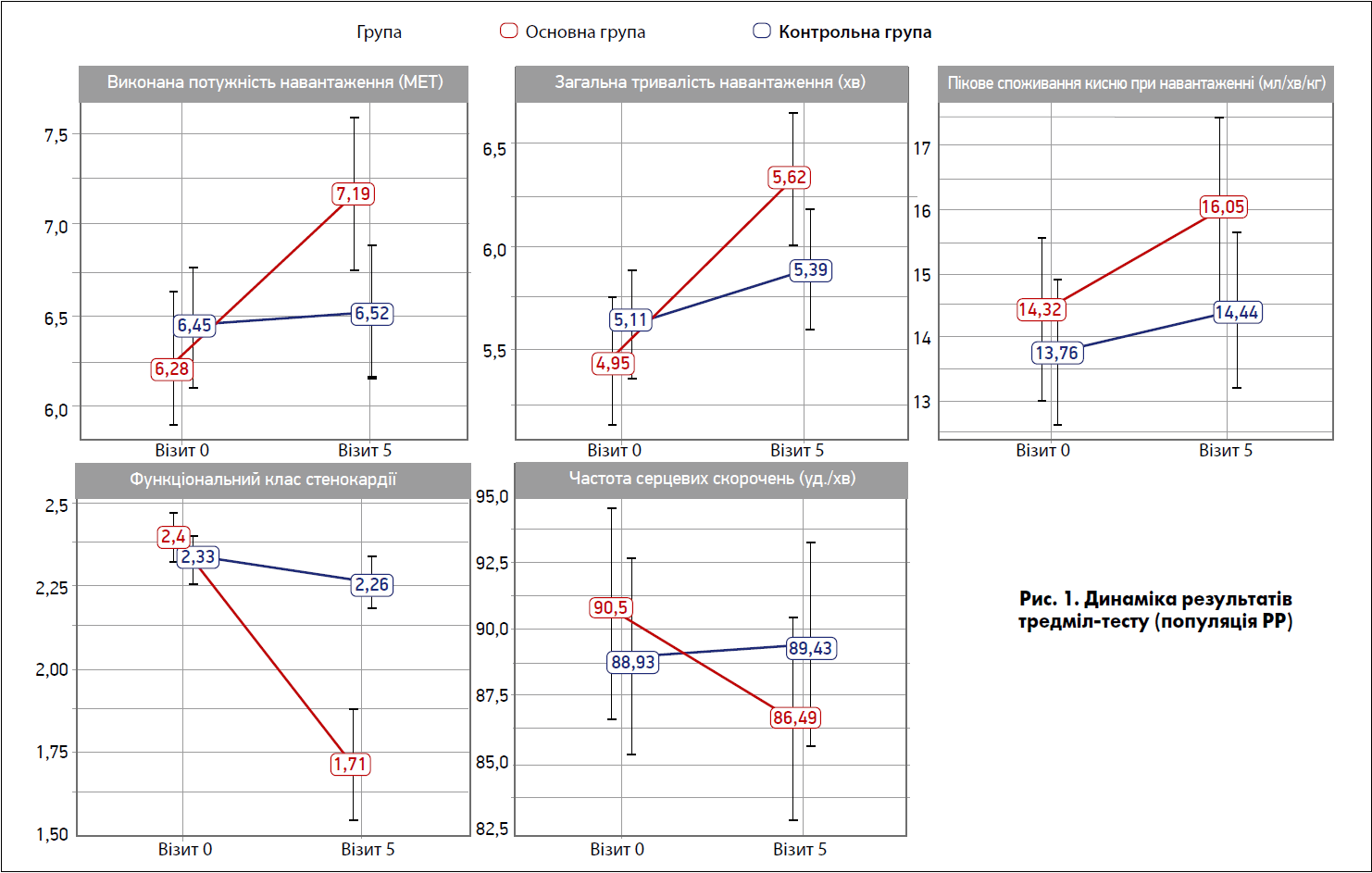
За вторинними критеріями ефективності було виявлено статистично значущу різницю між групами на користь комбінованої терапії щодо наступних показників:
- Кількість пацієнтів, у яких збільшення тривалості фізичного навантаження становило 1 хв після закінчення 21денного курсу лікування (у популяції всіх рандомізованих учасників згідно з призначеним лікуванням [ITT]).
- Збільшення пікового споживання кисню після закінчення курсу лікування порівняно з вихідним рівнем в обох популяціях аналізу.
- Підвищення потужності порогового навантаження після закінчення курсу лікування порівняно з вихідним показником в обох популяціях аналізу.
- Зменшення кількості нападів стенокардії в основній групі після закінчення курсу застосування препарату Тіворель на тлі стандартної терапії (рис. 2), прицьому у хворих лише на стандартному лікуванні показник підвищився.
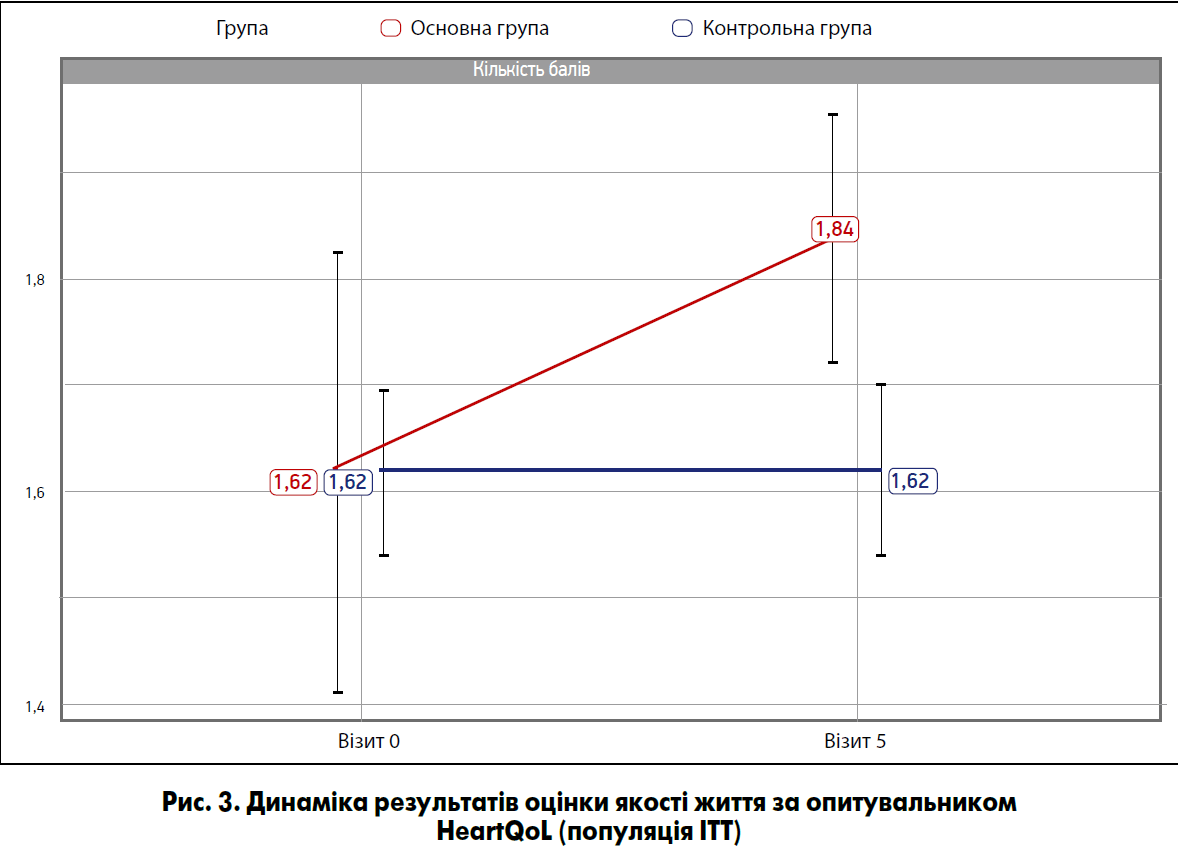
- Підвищення оцінки якості життя за опитувальником HeartQoL порівняно з вихідним рівнем у пацієнтів, які отримували Тіворель, а також середня різниця збільшення оцінки якості життя між групами терапії (у популяції ITT) (рис. 3).
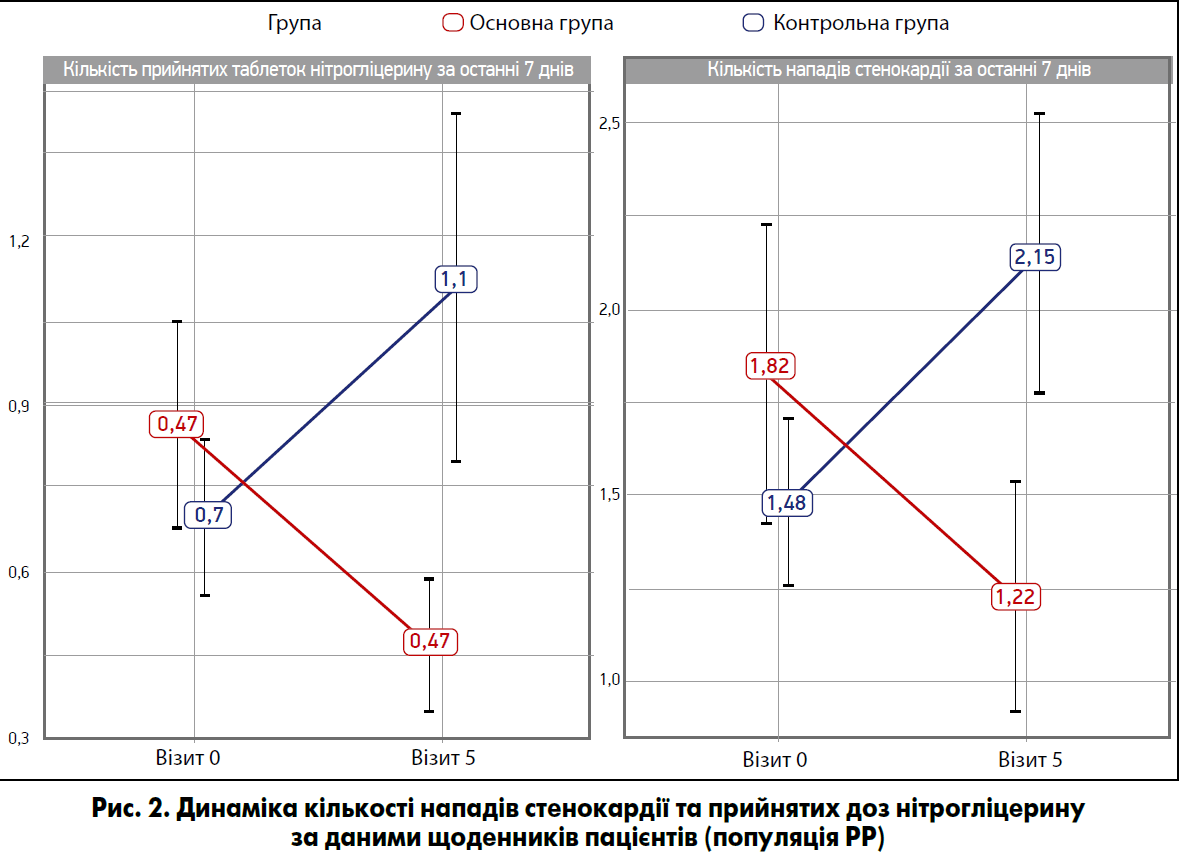
Інші вторинні критерії ефективності включали: кількість пацієнтів, у яких частота нападів стенокардії на тиждень скоротилася на 50% після курсу лікування порівняно з вихідним рівнем; кількість хворих, у яких досягнуте зменшення прийнятих таблеток нітрогліцерину на тиждень на 50% після закінчення курсу терапії порівняно з вихідним рівнем (рис. 2); зміну значення дисперсії QT, числа шлуночкових, надшлуночкових та змішаних порушень ритму після курсу лікування порівняно з базовим рівнем. За отриманими даними, статистично значимих відмінностей між групами терапії виявлено не було.
Водночас призначення комбінованої терапії з Тіворелем Аспартатом у хворих на ІХС характеризується прийнятним профілем безпеки, зіставним із застосуванням лише стандартних препаратів при ІХС, що робить його бажаним компонентом комплексного лікування хворих на ІХС.
Рекомендована схема патогенетичної терапії ІХС включає призначення Тіворелю Аспартату у вигляді розчину для інфузії (флакон) внутрішньовенно крапельно один раз на добу протягом перших 10 днів (швидкість введення протягом перших 10‑15 хв – 10 крапель на хвилину, після чого її можна збільшити до 30 крап./хв) або розчину для перорального застосування по 20 мл двічі на добу протягом 21 дня (згідно з інструкцією для застосування лікарського засобу).
Таким чином, своєчасне призначення комбінованої терапії з препаратом Тіворель Аспартат, що діє на метаболічному рівні, дозволяє досягти кращого клінічного ефекту, запобігти прогресуванню ІХС і розвитку таких ускладнень, як шлуночкові аритмії та блокади серця.
Автор:
- Сичов Олег Сергійович, д.мед.н., професор, Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска (м. Київ).