Застосування препарату Ізоніазид у формі сиропу в лікуванні та профілактиці туберкульозу у дітей
Пульмонолог, Фтизіатр
ДУ “Національний інститут фтизіатрії і пульмонології ім. Ф. Г. Яновського АМН України”
Щорічно у світі реєструється приблизно 9 млн. нових випадків туберкульозу. Близько 1млн (11%) припадає на дітей у віці до 15 років. Ізоніазид найбільш ефективний при свіжих гострих процесах, показаний для лікування активних форм туберкульозу різної локалізації у дорослих та дітей як основний препарат.
Із них 75% реєструється у 22 країнах із високою розповсюдженістю туберкульозу, що складає приблизно 80% випадків туберкульозу у дітей, які реєструються у світі. У цілому, в різних країнах на долю дітей припадає від 3 до 25% та більше випадків від загальної кількості осіб, що захворіли на туберкульоз [5].
Основним методом комплексного лікування хворих на туберкульоз є етіотропна (антимікобактерільна) терапія. До найбільш ефективних препаратів належить Iзоніазид, який застосовується як у комплексному комбінованому лікуванні хворих, так і при проведенні хіміопрофілактики [3, 4].
Профілактичне лікування, як спосіб запобігання туберкульозу, застосовується в усьому світі. Схеми хіміопрофілактики відрізняються переважно тривалістю лікування і коливаються від 3-х до 12-ти місяців у різних країнах. Ізоніазид (та його аналоги) єдиний препарат, який застосовується самостійно без поєднання з іншими протитуберкульозними препаратами [4, 5].
В Україні контингенти дітей групи ризику, які перебувають під наглядом дитячого фтизіатра, проходять відповідне обстеження і, в переважній більшості, профілактичне лікування, складають щороку близько 200 тис. осіб. Враховуючи тривалість лікування та вікові особливості дитини, важливим є застосування зручної форми препарату [2]. У лікуванні хворих використовують переважно Ізоніазид вітчизняних виробників: таблетовані форми , розчин для парентерального застосування та Ізоніазид у сиропі. Останній все ширше застосовується у педіатричній практиці.

Ізоніазид особливо активний проти штамів бацил ТБ, які швидко розмножуються і знаходяться у стінках порожнини в багатому киснем середовищі, при нейтральному рН. Ізоніазид інгібує ДНК-залежну РНК-полімеразу та гальмує синтез міколевих кислот клітинної стінки мікобактерії туберкульозу (МБТ). Препарату притаманна висока бактеріостатична та бактерицидна активність по відношенню до МБТ — їх ріст затримується при концентрації Ізоніазиду 0,03 мкг/мл. M. tuberculosis і M. Bovis високочутливі до Ізоніазиду, він слабо впливає на збудників інших інфекційних захворювань.
Препарат добре всмоктується зі шлунково-кишкового тракту, легко проникає через гематоенцефалічний бар’єр, у спинномозкову рідину, плевральний випіт, асцитичну рідину, мокротиння, слину, легені, шкіру, казеозні маси. Час досягнення максимальної концентрації в крові (Тmax) становить 1–4 години. Зв’язування з білками плазми крові складає до 10%. Об’єм розподілу 0,56–0,76 л/кг. Туберкулостатична концентрація після прийому в разовій дозі зберігається протягом 6–24 годин. Проникає через плаценту та екскретується з грудним молоком.
Метаболізується у печінці шляхом ацетилювання. Швидкість його генетично детермінована та зумовлена рівнем активності N-ацетилтрансферази. У залежності від швидкості ацетилювання хворих розподіляють на “швидких” і “повільних” інактиваторів. У “швидких” інактиваторів період напіввиведення Ізоніазиду становить 0,5–1,6 годин, а кількість незміненої речовини, виділеної нирками, менше 10% на добу. У “повільних” інактиваторів, відповідно, 2–5 годин та більше 10% на добу. У новонароджених період напіввиведення складає 7,8–19,8 годин, у дітей віком 1,5–15 років — 2,3–4,9 годин. Екскретується нирками переважно у вигляді неактивних метаболітів: протягом 24 годин із сечею виводиться 75–95% дози, що вводилась, незначна кількість виділяється з калом [4].
Ізоніазид найбільш ефективний при свіжих гострих процесах, показаний для лікування активних форм туберкульозу різної локалізації у дорослих та дітей як основний препарат.
У терапевтичних дозах Ізоніазид добре переноситься хворими. У рідкісних випадках може спостерігатися виникнення побічних реакцій: головокружіння, нудота, блювота, гастрит; інколи — підвищена втомлюваність, головний біль, порушення сну, парестезії, у дітей — збудження; в окремих випадках можливі порушення функції печінки, шкірні висипки, свербіння шкіри, еозинофілія, підвищення температури, біль за грудиною; у поодиноких випадках можливий розвиток гінекомастії, дисменореї у зв’язку зі стимуляцією кори надниркових залоз.
Ізоніазид протипоказаний при наявності підвищеної чутливості до нього. Обережно слід призначати препарат хворим на епілепсію, а також при інших захворюваннях, які супроводжуються схильністю до судом; у випадку перенесеного раніше поліомієліту; порушенні функції нирок та печінки; вираженому атеросклерозі. Прийом препарату у дозі вище 10 мг/кг протипоказаний при вагітності, легенево-серцевій недостатності ІІІ ступеню, гіпертонічній хворобі ІІ–ІІІ ступеню, ішемічній хворобі серця, поширеному атеросклерозі, захворюваннях нервової системи, бронхіальній астмі, псоріазі, екземі у фазі загострення, хронічній нирковій недостатності, гепатиті у фазі загострення, цирозі печінки, мікседемі.
Порівняльне дослідження ефективності та нешкідливості сиропної форми препарату проводилось у 60 дітей хворих на туберкульоз легенів віком від 6 до 18 років у відповідності до вимог, що пред’являються Державним фармакологічним центром МОЗ України до таких досліджень. Вивчення проводились шляхом відкритого порівняльного, паралельного клінічного дослідження. У 30 дітей основної групи застосовували вітчизняний препарат — Ізоніазид, сироп 100 мг/5 мл. Контрольну групу склали 30 дітей, також хворих на туберкульоз легень, які отримували препарат Ізоніазид, сироп 50 мг/5 мл фірми “Pharma scence Inc.” (Канада) також у комплексній терапії.
Пацієнти основної групи вживали Ізоніазид, сироп у дозі по 10 мг/кг (або 0,5 мл/кг) 1 раз на добу після сніданку щоденно протягом 2-х міс. Пацієнти контрольної групи отримували референтний препарат Ізоніазид, сироп також дозою 10 мг/кг (або 1,0 мл/кг) 1 раз на добу після сніданку щоденно протягом 2-х міс.
Сироп Ізоніазиду призначали в комплексній терапії разом з іншими антимікобактеріальними засобами, а саме — з рифампіцином і піразинамідом.
Досліджувані препарати призначали пацієнтам у складі комплексної терапії, яка включала патогенетичні препарати у віковій дозі: вітамін В6 (піридоксину гідрохлорид), кислота глутамінова, вітамін В1 (тіаміну хлорид), натрієва сіль аденозинтри фосфорної кислоти (АТФ), гепатопротекторний засіб на основі силімарину. Під час дослідження не дозволялось призначення: гепато- та нейротоксичних препаратів, антибіотиків, сульфаніламідів, непрямих коагулянтів, бензодіазепинів, фенитоіна, карбамазепинів, теофіліна, інгібіторів МАО.
Всіх пацієнтів за принципом випадковості розподілили в основну (30 осіб) та контрольну (30 осіб) групи, ідентичні за статтю, віком, місцем мешкання, тривалістю захворювання та ступенем вираження основних клінічних ознак.
Перед включенням хворого у дослідження оцінювали зібрані й зареєстровані в індивідуальній реєстраційній формі такі дані: демографічні (стать, вік), фізичні (зріст, маса тіла), анамнестичні (життя та захворювання), рентгенологічні (оглядова рентгенографія органів грудної порожнини, томографія), результати клінічного обстеження (огляд пацієнта, пальпація, перкусія, аускультація), показники артеріального тиску (АТ), частоти серцевих скорочень (ЧСС), температури тіла (t°), лабораторні (загальний аналіз крові, сечі, біохімічний аналіз крові), мікробіологічні (бактеріоскопія та посів мокротиння або промивних вод бронхів на МБТ).
Пацієнти, їх батьки (опікуни) давали інформовану згоду на участь у дослідженнях і потім адекватно співпрацювали з лікарями протягом всього терміну лікування й обстеження.
Спостереження й обстеження хворих виконували поетапно: скринінг (перші 2–3 дні при вступі у клініку) та весь період лікування (60 днів): 1–3, 15, 30, 45, 60-й дні. Періодичність досліджень та реєстрація даних проводилась у відповідності з розробленою схемою.
Усі дані обстеження вносились в історію хвороби та індивідуальну реєстраційну форму. Після обстеження включали у дослідження дітей із підтвердженим діагнозом туберкульозу легень і перевірки на відповідність критеріям включення/виключення, які наведені вище.
Згідно з протоколом досліджень, оцінку ефективності досліджуваного препарату проводили за такими критеріями:
— основні — динаміка клінічних проявів туберкульозу (суб’єктивні симптоми та скарги пацієнтів, об’єктивні дані, лабораторні тести); динаміка рентгенологічних даних;
— вторинні — динаміка бактеріовиділення за даними мікробіологічного дослідження мокротиння або промивних вод бронхів (у МБТ-позитивних пацієнтів).
— основні — динаміка клінічних проявів туберкульозу (суб’єктивні симптоми та скарги пацієнтів, об’єктивні дані, лабораторні тести); динаміка рентгенологічних даних;
— вторинні — динаміка бактеріовиділення за даними мікробіологічного дослідження мокротиння або промивних вод бронхів (у МБТ-позитивних пацієнтів).
Оцінку ефективності препарату проводили з використанням вищезазначених критеріїв за загальноприйнятою шкалою ефективності: препарат ефективний — препарат неефективний.
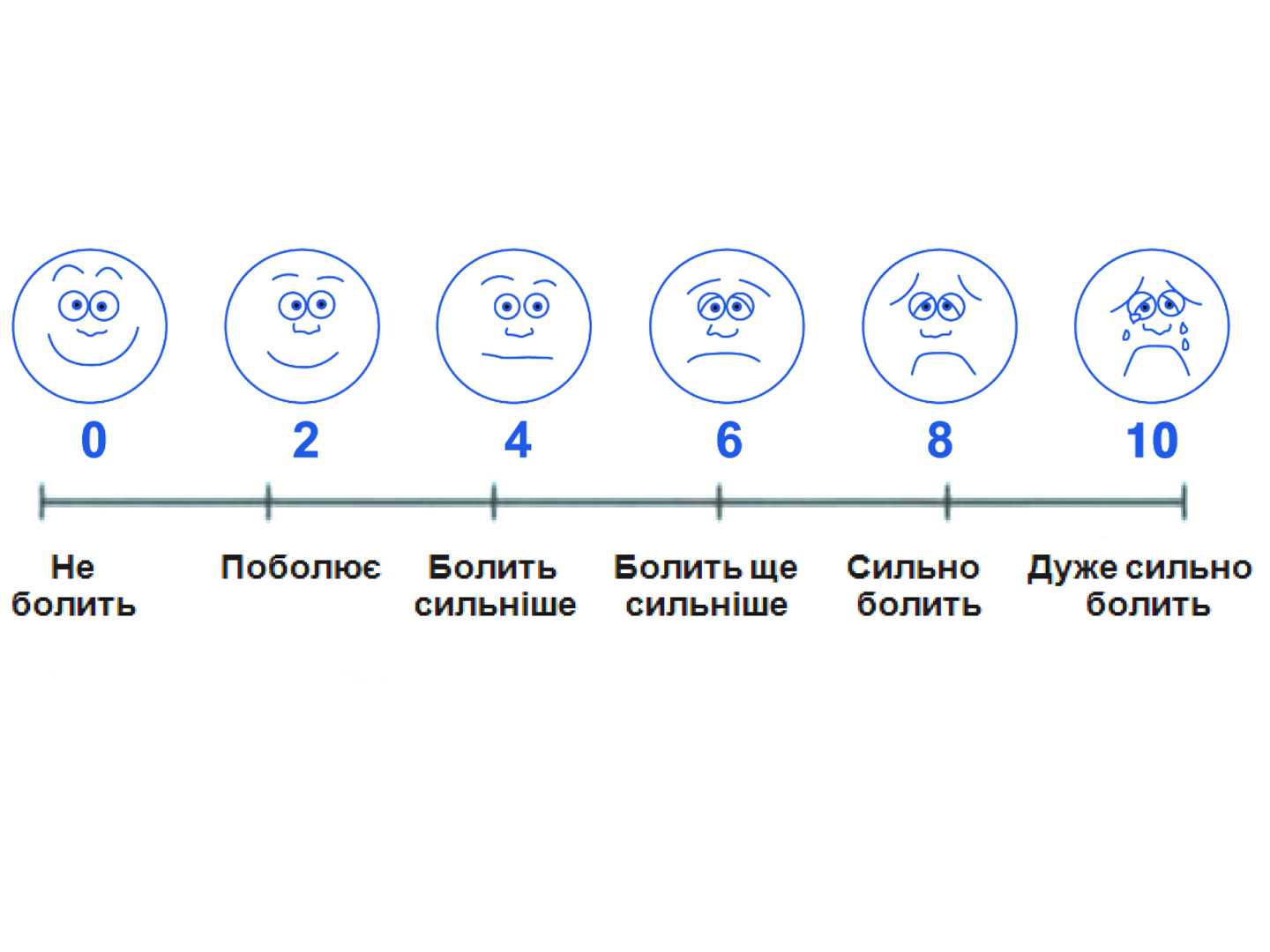
Шкалу розподілу ознак градуювали в балах відповідно до ступеню їх вираженості:
0 — відсутність ознаки;
1 — слабкий ступінь вираженості або просто наявність ознаки (у випадках градації “є-немає”);
2 — помірний ступінь вираженості;
3 — значний ступінь вираженості.
0 — відсутність ознаки;
1 — слабкий ступінь вираженості або просто наявність ознаки (у випадках градації “є-немає”);
2 — помірний ступінь вираженості;
3 — значний ступінь вираженості.
Переносимість препарату оцінювали на підставі суб’єктивних скарг і відчуттів пацієнта та об’єктивних даних, отриманих дослідником. Враховували динаміку лабораторних показників, а також частоту виникнення і характер побічних реакцій. Особливу увагу приділяли наступним ознакам: нудота, блювота, розлади з боку шлунково-кишкового тракту, біль в області шлунку, порушення функції печінки, дратівливість, збудженість, головокружіння, головний біль, ейфорія, порушення формули сну, парестезії, відчуття биття серця, біль за грудиною, алергічні (еозинофілія, свербіння та висипка на шкірі, підвищення температури тіла), периферичні неврити, психози, гінекомастія, меноррагії, гепатит. Переносимість препарату оцінювали за об’єктивними даними згідно зі шкалою оцінки переносимості препарату (переносимість — добра, задовільна, незадовільна).
В аналіз ефективності включали пацієнтів, які отримали повний курс лікування досліджуваними препаратами. Ті пацієнти, в яких було допущено будь-які порушення вимог протоколу дослідження (критерій включення/виключення, схема лікування тощо), в аналіз ефективності та переносимості досліджуваних препаратів не включались.
Статистичну обробку отриманих даних проводили параметричними методами із застосуванням критерію Стьюдента, якщо розподіл змінних у варіаційних рядах відповідав нормальному закону. В інших випадках використовували непараметричні методи та критерій Уілкоксона [5].
Вивчення динаміки клінічних ознак туберкульозу в процесі лікування виявило помітні позитивні зрушення на 30-й день лікування Ізоніазидом в комплексі з іншими препаратами. На 60-й день лікування у 87,6% хворих стан значно покращився.
За результатами рентгенологічного обстеження більшість дітей мали процес у фазі інфільтрації, третина — фазу розпаду й чверть пацієнтів — фазу обсіменіння. В динаміці лікування суттєвої різниці між групами за цими показниками не виявили. Під впливом лікування на 60-й день дослідження відмічалось розсмоктування більшості вогнищ відсіву та зменшення розмірів ділянок деструкції в легенях у (70,0 ± 8,3) % хворих основної групи та в (63,3 ± 7,9) % дітей контрольної, P >0,05. При цьому частота загоєння порожнин розпаду та розсмоктування вогнищ обсіменіння склала в основній групі по 6,7 %, в контрольній — по 3,3 % відповідно, P >0,05. Виражена позитивна рентгенологічна динаміка на кінець 2-го місяця спостереження у вигляді суттєвого розсмоктування інфільтратів у легенях відмічалось у (90,0 ± 9,5) % дітей основної та в (86,7 ± 9,3) % осіб контрольної груп, P > 0,05. Тобто, отримані дані свідчать про однакову ефективність досліджуваного та референтного препаратів.
Після проведеного лікування як в основній, так і в контрольній групах, достовірно знизилась кількість еозинофілів та лейкоцитів у периферичній крові, нормалізувалась ШОЕ, зріс вміст лімфоцитів.
За даними клінічного та біохімічного дослідження, обидва препарати будь-якої негативної дії на нирки та печінку не чинили.
Мікробіологічне дослідження мокротиння також проводилось в декретовані терміни. Так, перед початком лікування мікобактерії туберкульозу виділяли 2 (6,7%) хворих основної та 1 (3,3%) пацієнт контрольної групи. При контрольному обстеженні в декретовані строки бактеріовиділювачів не було.
Препарат, який вивчався, добре переносився більшістю пацієнтів і давав позитивний клінічний ефект. Переносимість лікування визначена як добра у 25 (83,3%) пацієнтів контрольної групи та в 29 (96,7%) осіб основної групи (Р > 0,05); як задовільна — у 4 (13,3 %) дітей контрольної групи та в 1 (3,3%) дитини основної групи (пацієнт № 14), Р > 0,05; незадовільна (нудота) — у 1 (3,3%) дитини контрольної групи. В основній групі незадовільного сприйняття ліків не спостерігалось. Можливих ускладнень та виражених побічних реакцій у хворих основної і контрольної груп не було, що свідчить про низьку токсичність препаратів.
Дані проведеного дослідження дозволяють рекомендувати застосування вітчизняного препарату Ізоніазид, сироп 100 мг/5мл як високоефективного медикаментозного засобу в лікуванні дітей, хворих на туберкульоз.
Препарат може бути рекомендований для проведення хіміопрофілактики туберкульозу та лікування ускладнень БЦЖ.