Терапия цервикальной неоплазии на фоне бактериального вагиноза
Цель исследования: оценить эффективность вагинального декаметоксина в период подготовки к эксцизии (конизации) шейки матки у женщин с HSIL (цервикальной интраэпителиальной неоплазией (ЦИН) II) на фоне инфицирования вирусом папилломы человека (ВПЧ) высокого онкогенного риска при бактериальном вагинозе (БВ) и использования вагинального геля с декаметоксином и гиалуроновой кислотой для улучшения репарации в послеоперационном периоде.
Материалы и методы. Обследовано 60 женщин с HSIL (ЦИН II) на фоне ВПЧ-инфекции штаммами высокого онкогенного риска и БВ, которым была выполнена петлевая эксцизия (конизация) шейки матки. Основной группе (n = 30) накануне хирургического лечения назначали терапию БВ раствором декаметоксина и пероральным метронидазолом сроком до 7 суток, после проведения эксцизии шейки матки применяли вагинальный гель с декаметоксином и гиалуроновой кислотой курсом 14 дней. Группа сравнения (30 пациенток) для терапии БВ использовала пероральный метронидазол в течение 7 суток. С помощью кольпоскопии проводили визуальный контроль шейки матки. По результатам ПЦР оценивали биоценоз влагалища. Элиминацию онкогенных штаммов ВПЧ оценивали методом ПЦР.
Результаты. Использование в составе комбинированной терапии HSIL (ЦИН II) препаратов декаметоксина обусловливало более быструю и полноценную эпителизацию раневой поверхности, чем стандартная терапия (ВР 0,27, 95% ДИ 0,10 – 0,71, р = 0,008). Через 3 месяца после применения препаратов декаметоксина определялось достоверное увеличение случаев нормализации вагинальной микробиоты (ВР 0,30, 95% ДИ 0,09 – 0,98, р = 0,047), увеличение количества лактобацилл в вагинальном секрете (ВР 0,31, 95% ДИ 0,11 – 0,84, р = 0,02). Через 6 месяцев комбинированной терапии установлено статистически достоверное влияние декаметоксина на элиминацию онкогенных штаммов ВПЧ (ВР 0,22, 95% ДИ 0,05 – 0,94, р = 0,04). Не отмечено ни одного побочного действия декаметоксина как во время проведения терапии, так и в более позднем сроке.
Выводы. Полученные результаты свидетельствуют об ускорении репаративных процессов шейки матки, выраженном противомикробном эффекте, элиминации онкогенных штаммов ВПЧ и безопасности вагинального использования декаметоксина до и после проведения петлевой эксцизии шейки матки у женщин с HSIL (ЦИН II) на фоне ВПЧ-инфекции штаммами высокого онкогенного риска при БВ.
Ключевые слова: интрацервикальная неоплазия высокой степени, штаммы высокого онкогенного риска вируса папилломы человека, бактериальный вагиноз, петлевая эксцизия, вагинальный микробиом, эпителизация, декаметоксин.
В настоящее время эпидемиологические исследования позволяют утверждать, что цервикальная неоплазия и рак шейки матки (РШМ) относятся к заболеваниям, обусловленным вирусной инфекцией [1, 8, 15]. Главным триггером патогенеза следует считать инфицирование вирусом папилломы человека (ВПЧ). ДНК ВПЧ высокой степени онкогенного риска (преимущественно 16-го и 18-го типов) выявляются в 65 86 % случаев умеренной и тяжелой цервикальной интраэпителиальной неоплазии (ЦИН) и обусловливают около 70 % случаев РШМ [5, 7, 11, 13]. Несмотря на современные методы лечения предраковых заболеваний, ассоциированных с ВПЧ, риск развития РШМ остается высоким. Ежегодно в мире диагностируется около 560 000 новых случаев РШМ, который является вторым наиболее распространенным раком у женщин [1, 12, 18].
Частота прогрессии ЦИН в карциному ко- леблется от 17 до 70 % [1, 6, 13]. Время, необходимое для развития опухолевого процесса, отличается, особенно у пациенток с наличием факторов риска. Считается, что для прогрессии у женщин с интрацервикальной неоплазией высокой степени (HSIL — high grade squamous intraepithelial lesion) в цервикальных мазках в инвазивный рак необходимо от 3 до 10 лет. У некоторых женщин этот скрытый период настолько продолжительный, что инвазия до конца жизни может так и не развиться. У других пациенток заболевание может манифестировать стремительно, в течение нескольких месяцев [1, 7, 11].
На данный момент установлена положительная корреляционная связь между бактериальным вагинозом (БВ) и персистенцией ВПЧ в цервикальном эпителии [3, 5, 9, 10]. БВ является наиболее ярким проявлением дисбиоза влагалища, что представляет собой инфекционный невоспалительный синдром, который формируется на фоне нарушения микроэкологии влагалища [2, 4]. Многочисленными исследованиями доказано влияние повышения рН влагалища с последующим развитием БВ на увеличение риска развития ЦИН [14, 16].
С учетом того что ЦИН может стать эта- пом к малигнизации плоского эпителия, основной клинической задачей является предотвращение прогрессирования ЦИН в РШМ. Результаты, приведенные в иностранных клинических рекомендациях, свидетельствуют о том, что ЦИН II и ЦИН ІІІ следует рассматривать только с позиции хирургического лечения. У сексуально активных девочек-подростков и молодых женщин количество случаев спонтанной регрессии процесса цервикальной неоплазии низкой степени (LSIL — low grade squamous intraepithelial lesion) (ВПЧ/ЦИН I) варьирует от 60 70 % в первый год, после трех лет может достигать 90 %. Примерно у 15 % изменения сохраняются дольше, у 30 % женщин они прогрессируют в тяжелую степень (HSIL) и у около 1 % — в инвазивную карциному. В первые 2 3 года с момента инфицирования может наблюдаться спонтанная регрессия, поэтому эксцизионные методы лечения неприемлемы в качестве стартовой терапии для таких пациенток [5, 17].
Также стоит отметить опасность недооценки степени тяжести поражения шейки матки (ШМ) согласно цитологическим исследованиям при наличии тяжелых поражений у больных. Так, среди пациенток с LSIL в 26 % случаев выявлена ЦИН II и в 5 % — ЦИН III [11]. Поскольку у 12 25 % ВПЧ-положительных женщин с ЦИН І в течение 4 лет может произойти прогрессия ЦИН, при отсутствии эффекта от консервативной терапии для таких пациенток в течение 2 лет рекомендованы хирургические методы лечения [1, 5, 6, 8].
Необходимым условием проведения оперативного вмешательства на половых органах является отсутствие воспалительного процесса. При большом арсенале предлагаемых в последние годы консервативных методов лечения добиться полной санации и скорой эпителизации раневой поверхности удается не всегда. Достаточно широкий спектр организмов в микробиоте влагалища затрудняет поиск надежного средства, который бы действовал на большинство их видов [9].
Указанным выше характеристикам соответствует декаметоксин, оказывающий выраженное бактерицидное действие на стафилококки, стрептококки, капсульные бактерии и фунгицидное действие на дрожжеподобные грибы, протистоцидное действие на трихомонады, вирусоцидное действие на вирусы. Высокоактивный в отношении микроорганизмов, устойчивых к антибиотикам, декаметоксин концентрируется на цитоплазматической мембране микробной клетки и соединяется с фосфатидными группами липидов мембран, нарушая проницаемость цитоплазматической мембраны микроорганизмов. Препарат не всасывается слизистыми оболочками и раневой поверхностью.
Цель исследования: изучение клинической эффективности использования раствора декаметоксина 0,2 % (препарат Дека- сан) в период подготовки к хирургическому вмешательству (расширенной петлевой эксцизии ШМ) у женщин с HSIL (ЦИН II) на фоне ВПЧ-инфекции штаммами высокого онкогенного риска при БВ и использования вагинального геля с декаметоксином, гиалуроновой и молочной кислотами (препарат Гинодек) для улучшения репарации в послеоперационный период.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом для проспективного исследования клинического эффекта раствора Декасан и вагинального геля Гинодек стали 60 женщин с морфологически верифицированной ЦИН ІІ на фоне ВПЧ-инфекции штаммами высокого онкогенного риска в ассоциации с БВ.
Исследование проводилось на клинических базах кафедры акушерства и гинекологии № 1 Винницкого НМУ им. Н. И. Пирогова и соответствовало принципам, изложенным в Хельсинской декларации Всемирной медицинской ассоциации (ВМА) (1989), пересмотренной Генеральной ассамблеей ВМА (Сеул, 2008). Участницы исследования предоставили письменное согласие на участие в нем. Исследование проводилось в рамках НИР «Прогнозирование и профилактика нарушений развития и функции женской репродуктивной системы в разные возрастные периоды и коррекция выявленных нарушений» и было утверждено комитетом по биомедицинской этике Винницкого НМУ им. Н. И. Пирогова (протокол № 1 от 22 января 2019 г.).
Обследование всех участников включало кольпоскопию, цитологическое, гистологическое и микробиологическое исследование. Комбинированное лечение заключалось в сочетании конизации (эксцизии) ШМ и поэтапного медикаментозного лечения с использованием перед оперативным вмешательством (1 этап) антисептика Декасан (с целью предоперационной санации). На втором этапе с 10 14-го дня после операции (после отхождения струпа) применялся вагинальный гель Гинодек.
В зависимости от условий исследования женщины были разделены на две равные клинические группы:
• Основная (первая) клиническая группа (n = 30), в которой пациенткам с ЦИН ІІ накануне хирургического лечения назначали терапию БВ с использованием раствора Декасан и приема метронидазола сроком до 7 суток. На 10 14- е сутки после проведения эксцизии ШМ применяли вагинальный гель Гинодек 5 мл курсом 14 дней.
• Группу сравнения (вторую) составили 30 пациенток, кото- рым для терапии БВ назначали перорально метронидазол в течение 7 суток. После хирургического вмешательства на ШМ была применена стандартная терапия, не предусматривавшая использование геля с декаметоксином.
Критерии включения в исследование:
• согласие и возможность принимать участие в исследовании;
• возраст от 25 до 50 лет;
• наличие ЦИН ІІ (с гистологической верификацией);
• ВПЧ-инфекции штаммами высокого онкогенного риска.
Критерии исключения и прекращения участия в исследовании:
• клиническое подтверждение инфекционного или воспалительного процесса в области оперативного вмешательства;
• наличие инфекционного процесса в организме больной, что может обусловить инфицирование раны;
• сахарный диабет;
• ВИЧ-инфекция, СПИД;
• иммуносупрессивные состояния, не связанные с ВИЧ/СПИД;
• возраст моложе 25 и старше 50 лет.
Всем женщинам было рекомендовано не применять спринцевание, интравагинальные или системные противомикробные препараты, кроме назначенной терапии, а также обязательно воздерживаться от половой жизни в послеоперационный период.
1. Первоочередные критерии оценки эффективности:
• визуальная оценка состояния слизистой: состояние эпителия, раневой поверхности, наличие/отсутствие воспалительного/некротического процесса;
• отсутствие аномальных результатов цитологического исследования эпителия ШМ;
• элиминация онкогенных штаммов ВПЧ.
2. Второстепенные критерии оценки эффективности:
• оценка биоценоза влагалища согласно результатам полимеразной цепной реакции (ПЦР).
3. Критерии оценки безопасности:
• побочные эффекты, связанные с применением вагинальных препаратов, содержащих декаметоксин.
Комплексное обследование пациенток включало расширенную кольпоскопию, исследование микрофлоры влагалищного содержимого микроскопическим методом (окрашивание по Граму). Тестирование на ВПЧ высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68-го типов) проводили методом ПЦР с типоспецифическими праймерами. Диагноз БВ верифицировали по диагностическим критериям Амселя (1984), вагинальный мазок оценивали по критериям Ньюджента (1991).
Первичный осмотр после лечения проводили через 1 месяц в первую фазу менструального цикла. Через три месяца всем пациенткам были проведены кольпоскопия, бактериологическое (ПЦР) и цитологическое исследования. Окончательный осмотр выполняли через 6 месяцев после проведения терапии (кольпоскопия, цитологическое исследование и ВПЧ-тестирование).
При анализе результатов лечения ЦИН ІІ оценивали:
• полный эффект — наличие завершенного процесса эпителизации, характеризующегося кольпоскопическими признаками многослойного плоского эпителия по всей поверхности экзоцервикса через 1 месяц после лечения;
• отсутствие эффекта или неполный эффект — наличие неполной эпителизации ШМ или сохранение патологического участка меньшего диаметра в течение 3 месяцев после констатации неполного эффекта;
• рецидив — повторное появление того же заболевания шейки матки через 3 и более месяцев после достижения полного эффекта. Вариационно-статистическая обработка результатов исследования была выполнена с помощью программ SPSS Statistics 22 и StatSoft Statistica 13 с обозначением основных вариационных показателей: средняя величина (М), средняя ошибка (m), среднеквадратическое отклонение (р). При различных видах статистического анализа критическое значение уровня значимости принимали равным 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Среди участников исследования 12 (40,0 %) пациенток 1-й группы и 14 (46,7 %) 2-й группы отмечали выделения из влагалища. Большинство пациенток (18 (60,0 %) и 17 (56,7 %) из 1-й и 2-й группы соответственно) обращали внимание на неприятный запах выделений, который появляется или усиливается во время менструации. Дискомфорт во влагалище беспокоил 8 (26,7 %) и 9 (30,0 %) обследованных 1-й и 2-й группы соответственно.
У всех пациенток были выявлены ВПЧ высокого онкогенного риска: 16-й и 18-й тип у 50 (83,3 %) женщин, 33-й тип — у 15 (25,0 %), 58-й тип — у 10 пациенток (16,7 %), у 8 (3,3 %) была выявлена ассоциация 16-го и 18-го типов и вагинальный дисбиоз (БВ). При этом более чем у половины женщин заболевание протекало бессимптомно, что отмечают и другие исследователи [13]. Это подтверждает точку зрения, что женщины с HSIL имеют более разнообразную микробиоту, чем женщины без ЦИН [14, 18].
При анализе структуры микробиоценоза влагалища нормоценоз не был обнаружен. У всех женщин определялось повышение рН влагалищной среды более 4,5. При микроскопии мазков, окрашенных по Граму, «ключевые» клетки как патогномонический признак БВ были обнаружены у 54 (90,0 %) пациенток. При ПЦР-тестировании отмечались характерные изменения качественного состава микрофлоры: отсутствие морфотипов лактобацилл, замена их на ассоциации Gardnerella vaginalis/Prevotella bivia/ Porphyromonas spp./Atopobium vaginae.
Таким образом, полимикробная структура возбудителей БВ была ассоциирована в ряде случаев с облигатно-анаэробными и факультативно-анаэробными микроорганизмами.
Через 1 месяц после проведенной эксцизии ШМ визуально отмечалось уменьшение зоны отека и гиперемии у пациенток основной группы. В основной клинической группе (пациентки с ЦИН II) полная эпителизация отмечалась у 26 женщин (86,7 %), которым проводили санацию раствором декаметоксина 0,2 % накануне хирургического вмешательства и применяли гель с декаметоксином и гиалуроновой кислотой после операции (табл. 1). В то же время у пациенток группы сравнения полная эпителизация через 1 месяц была диагностирована в 15 (50,0 %) случаях (относительный риск (ОР) 0,27, 95 % доверительный интервал (ДИ) 0,10 0,71, р = 0,008).
Таблица 1. Визуальная оценка состояния слизистой ШМ через 30 дней от начала лечения, абс. ч./%
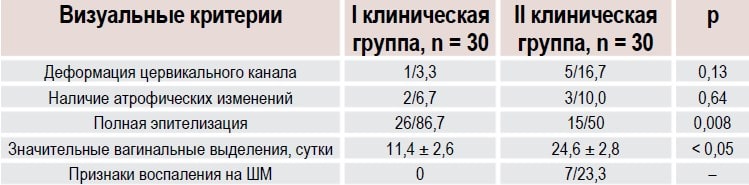
Заметим, что значительные выделения у пациенток основной клинической группы статистически достоверно продолжались 11,4 ± 2,6 суток, что было меньше, чем у женщин группы сравнения — 24,6 ± 2,8 суток (р < 0,05). Признаки атрофических изменений вагинального эпителия могли быть связаны с тем, что указанные пациентки находились в климактерическом периоде.
При анализе результатов исследования установлено, что в группе сравнения процессы репарации были несколько замедлены, у 7 женщин выявлены признаки воспаления ШМ, тогда как у пациенток, которые использовали раствор Декасан до проведения эксцизии ШМ и вагинальный гель Гинодек после хирургического вмешательства, аналогичные признаки не визуализировались.
Бактериологическое исследование, проведенное через 3 месяца, показало, что у большинства участниц исследования качественный состав влагалищного содержимого соответствовал показателям нормоценоза. У 27 (90,0 %) пациенток основной группы отмечалось нормальное состояние генитального биоценоза, при этом подобный результат в группе сравнения был диагностирован только у 20 (66,7 %) пациенток (ОР 0,30, 95 % ДИ 0,09 0,98, р = 0,047).
Анализ вагинальной микробиоты помог установить изменения лактобацилл через 3 месяца после оперативного лечения (табл. 2). У 26 (86,7 %) пациенток первой клинической группы, которые использовали вагинально препарат декаметоксина до и после хирургического вмешательства, была достоверно большее количество лактобацилл в вагинальном секрете сравнению с 17 (56,7 %) пациентками группы сравнения (ОР 0,31, 95 % ДИ 0,11 0,84, p = 0,02).
Таблица 2. Состояние вагинального биоценоза у женщин с HSIL (ЦИН II) в зависимости от комбинированной терапии через 3 месяца после эксцизии ШМ, абс. ч./%
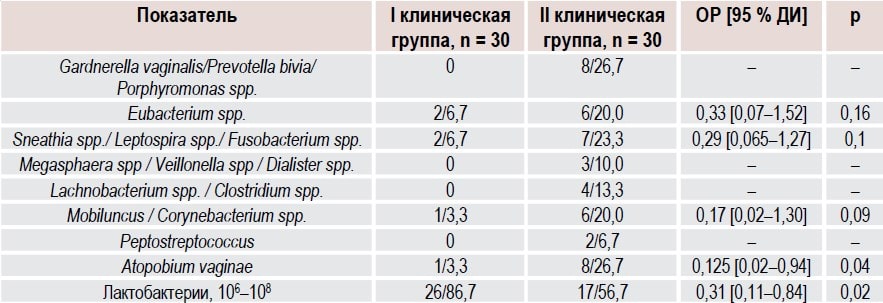
Так как молекулы декаметоксина и лактобациллы одинаково положительно заряжены, декаметоксин в составе раствора Декасан и геля Гинодек толерантен к лактобациллам и ему может быть присуще лактофлоросохраняющее действие.
При исследовании микробиоценоза влагалища также обращали внимание на количественный состав условнопатогенных микроорганизмов в цервикальной слизи. Было отмечено, что в результате предоперационного использования раствора Декасан курсом 7 дней и послеоперационного применения вагинального геля Гинодек курсом 14 дней произошло достоверное снижение показателей анаэробной условно-патогенной флоры по сравнению со 2-й группой.
В основной группе через 3 месяца после эксцизии (конизации) ШМ отсутствовала Gardnerella vaginalis и другие условно-патогенные бактерии, тогда как в группе сравнения указанные микроорганизмы были обнаружены у 8 пациенток (26,7 %). Количество случаев диагностики Eubacterium spp. было меньшим после лечения декаметоксином у женщин 1-й группы по сравнению со 2-й (ОР 10,33, 95 % ДИ 0,07 1,52, p = 0,16). Через 3 месяца после начала комбинированной терапии наблюдалось сравнительное уменьшение случаев диагностики комплекса Mobiluncus/Corynebacterium spp. у пациенток с HSIL (ЦИН II) 1-й и 2-й групп (ОР 0,17, 95 % ДИ 0,02 1,30, p = 0,09). Также достоверно уменьшилось количество случаев выявления Atopobium vaginae, вероятно ассоциированного с развитием БВ, у пациенток 1-й группы (ОР 0,125, 95 % ДИ 0,02 0,94, p = 0,04).
Через три месяца после оперативного лечения одной из особенностей репаративных процессов после комбинированной терапии HSIL (ЦИН II), выявленных с помощью кольпоскопии, была выраженная васкуляризация эпителиальной поверхности. Нормальная кольпоскопическая картина (или полная эпителизация) характеризовалась наличием многослойного плоского эпителия на всех зонах и квадрантах шейки матки, эпителиальный стык сохранен, строма обычная, сосуды удовлетворительно реагировали на 3%-й раствор уксусной кислоты, проба Шиллера была положительной.
Что касается времени полной репарации послеоперационных раневых дефектов ШМ, то она определялась в срок 34,6 ± 4,1 и 42,4 ± 4,7 суток соответственно у пациенток 1-й и 2-й групп исследования. Заживление операционной раны у женщин основной клинической группы происходило на фоне формирования нежного струпа, без развития рубцовой деформации ШМ.
При проведении цитологического исследования после трех месяцев от завершения терапии в обеих группах отмечали достоверное улучшение качества цитологической картины: уменьшение количества наблюдений цитологической картины третьего класса и увеличение цитологических изменений, характерных для первого-второго классов.
Через 6 месяцев после лечения наблюдалось большее количество случаев нормальной кольпоскопической картины в группах пациенток, получавших хирургическое лечение патологии ШМ на фоне БВ. Результаты контрольной кольпоскопии также свидетельствовали об отсутствии грубого рубцевания на ШМ во всех клинических группах.
Аномальная кольпоскопическая картина после лечения в виде слабого поражения (LSIL) была диагностирована у 2 (6,7 %) пациенток 2-й группы. Другие кольпоскопические картины, имевшие признаки воспаления, наблюдали у 3 пациенток этой же группы. Не было отмечено ни одного побочного действия на организм женщины вагинального использования препаратов декаметоксина как во время терапии, так и на более поздних сроках. Конфликт интересов Авторы заявляют, что достигли консенсуса и не имеют конфликта интересов.
Через 6 месяцев после лечения при контрольном цитологическом исследовании было диагностировано отсутствие интраэпителиального поражения или малигнизации у 54 (90 %) пациенток, обследованных и пролеченных в нашем проспективном клиническом исследовании (табл. 3).
Таблица 3. Результаты цитологического исследования у женщин с HSIL (ЦИН II) через 6 месяцев после комбинированной терапии
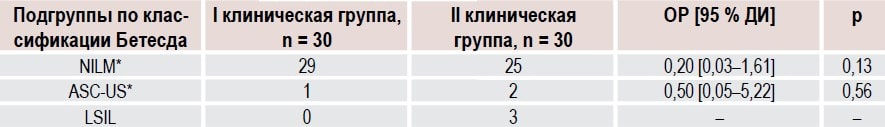
* NILМ (Negative for Intraepithelial Lesion or Malignancy) — интраэпителиальные изменения или малигнизация не обнаружены
** ASC-US (Аtypical Squamous Cells Undertermined Significance) — клетки плоского эпителия с атипией неясного значения
В первой группе с ЦИН цитологический контроль на фоне проводимого лечения показал регресс HSIL со 100,0 до 0,0 %.
При контроле ВПЧ-статуса через 6 месяцев после комбинированного лечения ВПЧ был обнаружен у 2 (6,7 %) женщин 1-й группы и у 9 (30,0 %) 2-й группы (ОР 0,22, 95 % ДИ 0,05 0,94, р = 0,04) (табл. 4). К тому же у пациенток второй группы наблюдалось сочетание нескольких типов ВПЧ высокоонкогенного риска.
Таблица 4. Результаты диагностики генотипов вируса у ВПЧ-положительных женщин с патологией ШМ после лечения
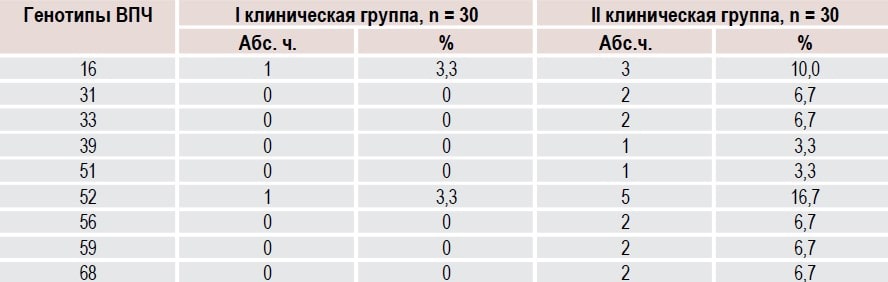
Не выявлено ни одного побочного действия раствора Декасан и вагинального геля Гинодек ни во время проведения терапии, ни в более поздние сроки.
По нашему мнению, лучший терапевтический эффект в комбинированном лечении HSIL на фоне БВ при использовании раствора Декасан и вагинального геля Гинодек был связан с тем, что декаметоксин обладает антимикробным, противогрибковым действием, концентрируется на цитоплазматической мембране микробной клетки и соединяется с фосфатидными группами липидов мембран, нарушая проницаемость упомянутой мембраны микроорганизмов.
Гель Гинодек поддерживает рН и влажность слизистой влагалища, благодаря чему устраняется дискомфорт и сухость. Кроме того, 0,5%-я гиалуроновая кислота, входящая в состав геля Гинодек, улучшает процессы репарации эпителия слизистой оболочки ШМ, устраняет сухость, укрепляет стенки влагалища и повышает их эластичность, благодаря чему улучшается качество жизни женщины.
ЗАКЛЮЧЕНИЕ
- Использование в составе комбинированной терапии HSIL (ЦИН II) препаратов декаметоксина и гиалуроновой кислоты приводило к более быстрой и полноценной эпителизации раневой поверхности, чем использование стандартной терапии (ОР 0,27, 95 % ДИ 0,10 0,71, p = 0,008).
- Через 3 месяца после вагинального применения препаратов декаметоксина определялось достоверное увеличение частоты нормализации вагинальной микробиоты (ОР 0,30, 95 % ДИ 0,09 0,98, p = 0,047), а также увеличение количества лактобацилл в вагинальном секрете (ОР 0,31, 95 % ДИ 0,11 0,84, p = 0,02).
- Через 6 месяцев после комбинированной терапии HSIL (ЦИН II) установлено статистически достоверное влияние вагинального использования раствора декаметоксина и вагинального геля с декаметоксином, гиалуроновой кислотой и лактатным буфером на содействие элиминации онкогенных штаммов ВПЧ (ОР 0,22, 95 % ДИ 0,05 0,94, р = 0,04).
- Не было отмечено ни одного побочного действия на организм жен-щины вагинального использования препаратов декаметоксина как во время терапии, так и на более поздних сроках.
Конфликт интересов: авторы заявляют, что достигли консенсуса и не имеют конфликта интересов.
Авторы:
• О.А. Таран, д. мед. н., профессор кафедры акушерства и гинекологии №1 Винницкого НМУ им. Н.И. Пирогова, г. Винница
• В.А. Рудь, д. мед. н., профессор кафедры акушерства и гинекологии №2 Винницкого НМУ им. Н.И. Пирогова, г. Винница
• О.В. Булавенко, д. мед. н., профессор, зав. кафедрой акушерства и гинекологии №2 Винницкого НМУ им. Н.И. Пирогова, г. Винница
• Д.Г. Коньков, д. мед. н., профессор кафедры акушерства и гинекологии №1 Винницкого НМУ им. Н.И. Пирогова, г. Винница
Литература:
- Володько, Н.А. Український національний консенсус з обстеження та лікування жінок після проходження первинного цервікального скринінгу / Н.А. Володько, А.Б. Вінницька, В.В. Камінський [та ін.] // Репродуктивна ендокринологія. – 2018. – №5 (43). – С. 8–14.Volodko, N.A., Vinnytska, A.B., Kaminskyi, V.V., et al. “Ukrainian national consensus on the examination and treatment of women after primary cervical screening.” Reproductive Endocrinology 5.43 (2018): 8–14.
- Коньков, Д.Г.Клінічна ефективність вагінальних супозиторіїв, що містять мірамістин, у користувачів акушерського песарію при неспецифічному вагініті / Д.Г. Коньков, А.В. Старовєр, О. В. Булавенко, А. В. Вознюк // Здоровье женщины. – 2017. – №7. – С. 2–7.Konkov, D.G., Starover, A.V., Bulavenko, O.V., Vozniuk, A.V. “The clinical efficiency of vaginal suppositories containing miramistin, for pregnant women with nonspecific vaginitis before installation of cervical pessaries.” Woman’s Health 7 (2017): 2–7.
- Коньков, Д.Г. Особливості клінічного застосування пробіотиків в акушерській практиці / Д.Г. Коньков // Здоровье женщины. – 2020. – № 3. – С. 42–47.Konkov, D.G. “The features of clinical applying of probiotics in obstetric practice.” Woman’s health 3 (2020): 42–7.
- Коньков, Д.Г. Особливості комплексної терапії бактеріального вагінозу у вагітних із порушенням затульної функції шийки матки / Д.Г. Коньков, Н.В. Адамчук, В.В. Кливак // Репродуктивна ендокринологія. – 2020. – №4 (54). – С. 59–65.Konkov, D.G., Adamchuk, N.V., Klivak, V.V. “The features of complex therapy of bacterial vaginosis in pregnant women with cervical incompetence.” Reproductive endocrinology 4.54 (2020): 59–65.
- Таран, О.А.Клінічний досвід в оптимізації репаративних процесів шийки матки після деструктивно-хірургічних втручань / О.А. Таран, О.В. Булавенко, Д.Г. Коньков, Т.В. Лобастова // Здоровье женщины. – 2019. – №3 (139). – С. 38–42.Taran, O.А., Bulavenko, O.V., Konkov, D.G., Lobastova, T.V. “Clinical advice in the optimization of the reparative processes of the uterine cervix due to destructive surgical involvement.” Woman’s health 3.139 (2019): 38–42.
- Таран, О.А. Сучасний погляд на оптимальну терапію ВПЛ-асоційованої патології шийки матки на тлі вагінального дисбіозу / О.А. Таран, О.В. Булавенко, Д.Г. Коньков, Т. В. Лобастова // Репродуктивна ендокринологія. – 2018. – №6 (44). – С. 16–20.Taran, O.А., Bulavenko, O.V., Konkov, D.G., Lobastova, T.V. “The modern view on optimal therapy of HPV-associated pathology of cervix at the vaginal dysbiosis background’s.” Reproductive endocrinology 6.44 (2018): 16–20.
- Aitken, C.A., Siebers, A.G., Matthijsse, S.M., et al. “Management and treatment of cervical intraepithelial neoplasia in the Netherlands after referral for colposcopy.” Acta Obstet Gynecol Scand 98.6 (2019): 737–46.
- Chao, Y.S., McCormack, S. HPV Self-sampling for primary cervical cancer screening: a review of diagnostic test accuracy and clinical evidence – An Update. Ottawa (ON). Canadian Agency for Drugs and Technologies in Health (2019).
- Champer, M., Wong, A.M., Champer, J., et al. “The role of the vaginal microbiome in gynaecological cancer.” BJOG 125.3 (2018): 309–15.
- Chehoud, C., Stieh, D.J., Bailey, A.G., et al. “Associations of the vaginal microbiota with HIV infection, bacterial vaginosis, and demographic factors.” AIDS 31.7 (2017): 895–904.
- Demarco, M., Egemen, D., Raine-Bennett, T.R., et al. “A study of partial human papillomavirus genotyping in support of the 2019 ASCCP Risk-Based Management Consensus Guidelines.” Journal of Lower Genital Tract Disease 24.2 (2020): 144–7.
- Jansen, E.E.L., Zielonke, N., Gini, A., et al. “Effect of organised cervical cancer screening on cervical cancer mortality in Europe: a systematic review.” European Journal of Cancer 27 (2020): 207–23.
- Gilham, C., Sargent, A., Kitchener, H., Peto, J. “HPV testing compared with routine cytology in cervical screening: long-term follow-up of ARTISTIC RCT.” Health Technol Assess 23 (2019).
- Liang, Y., Chen, M., Qin, L., et al. “A meta-analysis of the relationship between vaginal microecology, human papillomavirus infection and cervical intraepithelial neoplasia.” Infect Agent Cancer 14 (2019): 29.
- Perkins, R.B., Guido, R.S., Castle, P.E., et al. “ASCCP risk-based management consensus guidelines for abnormal cervical cancer screening tests and cancer precursors. 2019 ASCCP Risk-Based Management Consensus Guidelines Committee.” J Low Genit Tract Dis 24 (2020): 102–31.
- Sodhani, P., Gupta, S., Gupta, R., Mehrotra, R. Bacterial vaginosis and cervical intraepithelial neoplasia: is there an association or is co-existence incidental?. Asian Pac J Cancer Prev. 2017; 18(5): 1289-1292.
- Taran, O., Konkov, D., Lobastova, T. “The criteria for prognostic monitoring of cervical neoplasia.” The proceedings of the 27th biannual European Congress of Obstetrics and Gynaecology EBCOG. Bergen, Norway (2020).
- World Health Organization. Introducing and scaling up testing for human papillomavirus as part of a comprehensive programme for prevention and control of cervical cancer: a step-by-step guide. Geneva. WHO (2020).






