Путь к индивидуализации инфузионной терапии неотложных состояний согласно концепции ROSE

Аннотация
Статья посвящена роли внутривенной жидкостной терапии в условиях нарушения гомеостаза жидкостей, часто возникающей во время обширных хирургических вмешательств и критических состояний, таких как сепсис и травмы. Описывается важность адекватного введения жидкостей для поддержания клеточного гомеостаза, а также управления состояниями, связанными с гиповолемией и гемодинамическими нарушениями. Отмечается, что, несмотря на многочисленные исследования, тема оптимальных стратегий использования жидкостей остается дискуссионной, с потенциальными рисками негативного влияния чрезмерного введения жидкостей на клинические результаты.
Представлена концепция жидкостной ресусцитации ROSE, которая включает четыре этапа: ресусцитация, оптимизация, стабилизация и эвакуация. Эта концепция поможет врачам в принятии решений по управлению жидкостной терапией. Рассматриваются различные типы жидкостей, включая сбалансированные растворы и многофункциональный гиперосмолярный раствор Реосорбилакт, а также подчеркнута важность индивидуализации терапии в зависимости от потребностей каждого пациента. Подчеркнута важность потребности в тщательном мониторинге и контроле жидкостного баланса, чтобы избежать осложнений и обеспечить улучшение клинических результатов.
Вступление
 Нарушение гомеостаза в организме часто наблюдается при больших хирургических вмешательствах и критических состояниях, таких как сепсис и травмы. Важным аспектом менеджмента во время этих ситуаций является введение соответствующих внутривенных растворов как компонентов жидкостной ресусцитации. Внутривенная жидкостная терапия играет важную роль в установлении и поддержании клеточного гомеостаза у госпитализированных пациентов. Самые распространенные показания для внутривенного введения большого объема жидкости у критически больных пациентов включают управление тяжелой гиповолемией, сепсисом, внутриоперационную коррекцию больших потерь крови, гемодинамические нарушения, олигурию или их комбинацию.
Нарушение гомеостаза в организме часто наблюдается при больших хирургических вмешательствах и критических состояниях, таких как сепсис и травмы. Важным аспектом менеджмента во время этих ситуаций является введение соответствующих внутривенных растворов как компонентов жидкостной ресусцитации. Внутривенная жидкостная терапия играет важную роль в установлении и поддержании клеточного гомеостаза у госпитализированных пациентов. Самые распространенные показания для внутривенного введения большого объема жидкости у критически больных пациентов включают управление тяжелой гиповолемией, сепсисом, внутриоперационную коррекцию больших потерь крови, гемодинамические нарушения, олигурию или их комбинацию.
Несмотря на годы исследований, продолжается широкое обсуждение оптимальных стратегий дозирования жидкостей и надлежащего их состава для конкретных клинических условий. Эти исследовательские вопросы остаются актуальными, поскольку имеющиеся данные литературы указывают на то, что стратегии введения жидкостей могут значительно влиять на клинические результаты, однако до сих пор нет единодушного мнения по этому поводу. Действительно, использование определенных типов и объемов жидкостей может увеличивать риск негативных последствий, включая даже смерть, у некоторых групп пациентов. Ведь ненадлежащее использование жидкостей может быть обнаружено почти у 20 % пациентов, получающих жидкостную терапию.
Исследования в области жидкостной терапии постоянно совершенствуется благодаря новейшим достижениям в базовых областях физиологии. Особенно важным является понимание структуры сосудистого эндотелия и способа распределения жидкости на капиллярном уровне. Отмечается прогресс в фармакокинетическом моделировании движения экзогенных жидкостей между жидкостью организма. С каждым годом, все больше проводится клинических испытаний с целью опровержения или подтверждения предыдущих литературных данных, основанных преимущественно на небольших одноцентровых исследованиях [1, 2].
Ресусцитация жидкостями коллоидных и кристаллоидных растворов является распространенной в медицине неотложных состояний. Выбор и использование реанимационных жидкостей основывается на физиологических принципах, однако клиническая практика в значительной степени определяется выбором врача, однако существует выраженная региональная вариация. Идеального раствора для жидкостной ресусцитации не существует. Нет окончательного мнения в крупных рандомизированных исследованиях, а результаты небольших исследований обычно разнонаправленные. Поэтому логично, что появляются новые и основательные работы о типе и дозах жидкостей для ресусцитации, которые могут повлиять на результаты лечения пациентов.
Несмотря на то, что можно взять за основу физиологические принципы, коллоидные растворы не обеспечивают существенных преимуществ перед кристаллоидными растворами в отношении гемодинамических эффектов. Альбумин считается общепризнанным коллоидным раствором, но его использование ограничивается стоимостью и рядом недостатков. Хотя признано, что альбумин является безопасным для использования в качестве реанимационного раствора у большинства критически больных пациентов и может играть роль на начальных стадиях сепсиса, его использование связано с увеличением смертности среди пациентов с черепно-мозговыми травмами.
Использование растворов гидроксиэтилкрахмала связано с увеличением частоты проведения заместительной почечной терапии и негативными явлениями среди пациентов на интенсивном уходе. Нет доказательств на рекомендацию использования других полусинтетических коллоидных растворов.
Сбалансированные кристаллоиды являются базовыми жидкостями для начала жидкостной ресусцитации, хотя существует мало прямых доказательств об их сравнительной безопасности и эффективности. А чрезмерное использование физиологического раствора, как классического препарата в инфузионной терапии доказанно способствует развитию метаболического ацидоза и острой почечной недостаточности.
Существуют данные, свидетельствующие о положительном влиянии гипертонического раствора натрия хлорида на уменьшение капиллярной утечки и эндотелиальную адгезию нейтрофилов. Гипертонический натрия хлорид повышает артериальное давление за счет активации гипоталамо-гипофизарно-адреналовой системы, способствует увеличению тонуса сосудов и задержке жидкости в сосудистом русле. Однако при использовании имеет свои недостатки в виде избытка ионов хлора и натрия, что может привести к повреждению почек с последующим снижением скорости клубочковой фильтрации, а также развитию коагулопатии [32, 33].
Гиперосмолярность может подавлять сосудистую утечку без ущерба для врожденного иммунного ответа сосудистой микрофизиологической системы. Кроме того, изначальная гиперосмолярность приводит к длительной барьерной защите даже после изоосмотического восстановления. В целом проактивное лечение пациентов с сепсисом гиперосмотическими агентами может вызвать длительную защиту сосудов и в результате остановить разрушительные воспалительные каскады при тяжелом сепсисе [34].
Все ресустиционные жидкости могут способствовать образованию межклеточного отека, особенно при наличии воспаления и при использовании жидкостей в чрезмерных количествах. Врачи интенсивной терапии должны рассматривать использование ресустиционных жидкостей так же, как любой другой интравенозный препарат. Выбор конкретного раствора должен основываться на показаниях, противопоказаниях и потенциальных токсических эффектах с целью максимизации эффективности и минимизации рисков [3].
Клинические исследования часто демонстрируют, что менее чем у 50 % гемодинамически нестабильных пациентов наблюдается реакция на жидкостную терапию. У пациентов с, например, заболеваниями сердца, чрезмерное введение жидкости может быть вредным. Кроме того, во время жидкостной ресусцитации происходят кратковременные явления перераспределения жидкости и гемодинамической реакции у пациентов, с последующим возвращением объема крови к базовому уровню через 30–60 минут после начального введения жидкости. А у критически больных пациентов с повреждением эндотелия и капиллярной утечкой менее 5 % жидкостного пула остается интраваскулярно после 90 минуты [4, 5, 6, 7].
Большой объем ресусцитации жидкостями приводит к тяжелому отеку тканей и клиническим признакам передозировки жидкостью. Отек тканей затрудняет диффузию кислорода и метаболитов, искажает архитектуру тканей, препятствует кровообращению в капиллярах и лимфатическому дренажу и нарушает взаимодействие клеток. Эти эффекты особенно выражены в капсулированных органах, таких как печень и почки, которые не имеют способности вмещать дополнительный объем без увеличения межклеточного давления, что приводит к нарушению кровообращения в органе и его ишемии. Кроме того, большой объем жидкости увеличивает внутрибрюшное давление, что в дальнейшем уплотняет почечный и печеночный кровоток.
Таким образом, капиллярная утечка значительно способствует развитию внутрибрюшной гипертензии. Многие исследования показали, что положительный баланс жидкости ассоциируется с нарушением функции органов и увеличенным риском смертности. Однако до сих пор остается в значительной степени недоказанным, ассоциируется ли с улучшением лечения стратегии, направленные на нейтральный или даже отрицательный жидкостный баланс после начальной фазы ресусцитации. Благодаря положительным результатам в работах последних лет, цель-ориентированная терапия стала распространенной стратегией, целью которой является быстрая коррекция шока и гипоперфузии в течение нескольких часов.
Относительно руководств широко известной компании «Выживание во время сепсиса», что главным образом фокусируется на начальной ресусцитации большими объемами, имеет существенное ограничение, в связи с тем, что отсутствует информация по оценке перегрузки объемом (что не является рекомендуемым в большом количестве клинических ситуаций), а тем более не имеет установок когда и как проводить разгрузку. В этом ракурсе следует заметить, что центральное венозное давление отражает мало полезной информации относительно общего достижения необходимого объема проведенной инфузии пациента и необходимости разгрузки [8, 9, 10, 11].
В периоперационном периоде определенная степень гиперволемии необходима для поддержания перфузии органов. Однако жидкость, которую вводят после введения анестезии, в основном увеличивает «неразветвленный» объем крови, что связано с вазодилатацией, возникающей вследствие анестезии. На этот момент требуется дополнительное введение жидкости для оптимизации сердечного выброса, то есть дополнительная инфузия до «разветвленного» интраваскулярного объема.
Многие врачи все еще рассматривают этот «влажный» подход как золотой стандарт для внутриоперационной жидкостной терапии, хотя расширение интраваскулярного объема, бесспорно, несет определенные предостережения. Работа миокарда и кардиальное давление возрастают, когда объем жидкости превышает степень вазодилатации вызванной анестезией. Более того, перегрузка жидкостью снижает коллоидно-осмотическое давление, что, совместно с повышенным кардиальным давлением, может способствовать пульмональному отеку. Эти вопросы имеют особое значение для пациентов с неблагоприятным кардиоваскулярным статусом [12, 13, 14].
Введение жидкости является одним из основных аспектов интенсивной терапии у критически больных пациентов. Вопрос, сколько жидкости следует вводить, является предметом оживленных дискуссий на протяжении многих лет. Чрезмерное введение жидкости может иметь вредные последствия для различных органов и систем, например ухудшать газообмен, функцию почек и заживление ран. Перегрузка жидкостью особенно вероятно возникает в условиях измененной проницаемости капилляров из-за воспалительной реакции, такой как при сепсисе. Положительный баланс жидкости ассоциировался с худшими результатами в нескольких исследованиях различных групп пациентов в отделении интенсивной терапии (ОИТ).
У пациентов с септическим шоком введение жидкости и положительный баланс жидкости были независимо связаны с повышенными показателями смертности. Аналогично, у пациентов, которые были госпитализированы в ОИТ после обширных хирургических вмешательств, баланс жидкости оказался независимым фактором риска смерти. Действительно, ограничительная стратегия введения жидкости, направленная на достижение отрицательного баланса жидкости у пациентов с острым повреждением легких, ассоциировалась с улучшением результатов в ретроспективных исследованиях [15, 16, 17, 18, 19].
Недостаточная ресусцитация из-за недостаточного введения жидкости, наоборот, может привести к худшей перфузии тканей и, следовательно, к дисфункции органов и их недостаточности, особенно на ранних стадиях лечения. Необходимо достичь баланса, чтобы каждый пациент получал достаточно, но не чрезмерно, то есть в соответствии с его потребностями. Крайне важно, что разные пациенты будут иметь разные потребности и базовый статус жидкости в зависимости от многих факторов, таких как возраст, сопутствующие заболевания и имеющийся диагноз. Кроме того, необходимо учитывать показатели толерантности к жидкости, такие как центральное венозное давление (ЦВД), оксигенация и уровни гемоглобина. Потребность в жидкости меняется на протяжении болезни.
Таким образом, жидкости должны назначаться с расчетом на каждого пациента индивидуально; назначение следует регулярно пересматривать и корректировать в соответствии с изменяющимся клиническим состоянием. Ответ на вопрос, является ли перегрузка жидкостью проблемой в ОИТ, будет зависеть от момента, в который он поставлен. В фазе острой реанимации/ресусцитации введение жидкости должно быть массивным. Хотя перегрузка жидкостью всегда должна быть предметом беспокойства, положительный баланс жидкости является специфической целью этой фазы [14].
Учитывая отсутствие сбалансированной стратегии в решении этих вопросов и отсутствия адекватных или более или менее однозначных ответов, что касается жидкостной ресусцитации больных в критических состояниях, в последние годы на основе работ Hoste E.A. и соавт. [2], Malbrain M. и соавт. [8] и Vincent J.L. [20] была сформирована концепция жидкостной ресусцитации ROSE с соответствующими фазами: R — ресусцитация, O — оптимизация, S — стабилизация, и E — эвакуация (рис. 1.).
РИС. 1. Фазы жидкостной ресусцитации в течение шока. Адаптировано Malbrain M. и соавт. [8, 14]. 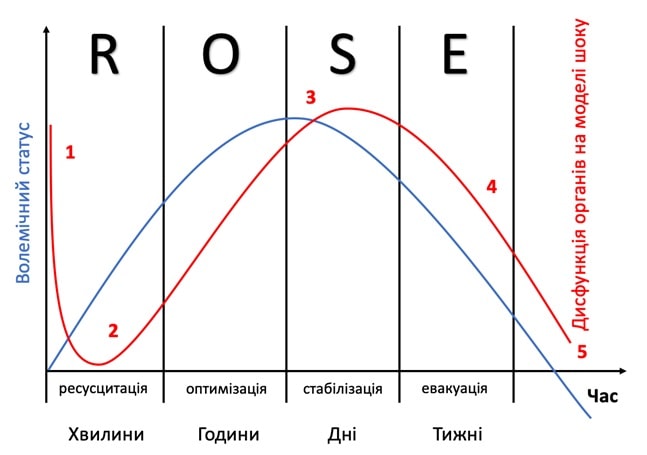
График синего цвета, показывающий динамику кумулятивного объема жидкости у пациентов в течение пяти различных фаз жидкостной реанимации шокового состояния: ресусцитация (R), оптимизация (O), стабилизация (S) и эвакуация (E) (ROSE), за которыми следует возможный риск гипоперфузии (5) в случае чрезмерной декомпенсации.
Красный график, иллюстрирующий «четырехстадийную модель шока» в соответствии с влиянием на функцию органов в зависимости от уровня жидкости в организме. При поступлении пациентов наблюдается гиповолемия (1), за которой следует нормоволемия (2) после жидкостной ресусцитации и перегрузки жидкостью (3), опять же за ней следуют фазы нормоволемии (4) и гиповолемии с риском гипоперфузии (5). В случае гиповолемии (фазы 1 и 5) кислород не может попасть в ткани из-за проблем с его доставкой, в случае гиперволемии (фаза 3) кислород не может попасть в ткани из-за проблем диффузии, что связано с межклеточным и легочным отеком, отеком кишечника (илеус и абдоминальная гипертензия).
Фаза ресусцитации (R) В первой фазе спасения/реанимации, когда пациент находится в состоянии гемодинамического шока, а целью лечения является ресусцитация и коррекция шока с достижением адекватного перфузионного давления. Эта фаза тяжелого шока, которая может угрожать жизни, возникает в течение нескольких минут и характеризуется низким средним артериальным давлением, низким сердечным выбросом и нарушениями микроциркуляции.
Могут быть проблемы с доставкой кислорода к тканям, в условиях тяжелой гиповолемии. Нужно быстро ввести болюс жидкости (хотя точное количество может варьироваться, обычно 3–4 мл/кг вводят в течение 10–15 минут и повторяют, если нужно), обычно и иногда даже желательно в сопровождении введения вазопрессоров. Параллельно необходимо выполнить неотложные процедуры для устранения любой очевидной основной причины, а также начать гемодинамический мониторинг.
В этой фазе цель заключается в раннем адекватном целенаправленном управлении жидкостью: баланс жидкости должен быть положительным. Большинство авторов не поддерживают слепое следование рекомендациям кампании «Выживание от сепсиса» с соблюдением правил введения 30 мл/кг жидкости в течение первого часа для всех пациентов, как было указано ранее. Это может привести к перегрузке или недостаточной жидкостной ресусцитации некоторых пациентов. Каждый пациент нуждается в индивидуальном и персонализированном подходе. Целью является раннее адекватное целенаправленное управление жидкостью (EAFM).
Баланс жидкости должен быть положительным, а цели жидкостной ресусцитации следующие: среднее артериальное давление (MAP) > 65 мм рт. ст., сердечный индекс (CI) > 2,5 л/мин/м², положительный цикл давления (PPV) < 12 %, индекс конечного диастолического объема левого желудочка (LVEDAI) > 8 см/м².
Фаза оптимизации (О). Фаза оптимизации начинается, когда пациент больше не находится в явной абсолютной или относительной гиповолемии, но остается гемодинамически нестабильным. Во время этой фазы ситуация остается нестабильной, но пациент больше не находится в непосредственной опасности для жизни; скорее всего, он находится на стадии компенсированного шока (все еще с высоким риском декомпенсации). Любая дополнительная жидкостная терапия должна вводиться осторожнее и титроваться с целью протекции сердечной функции для улучшения перфузии тканей с конечной целью избежать дисфункции или недостаточности органов.
На этом этапе уже будут внедрены какие-то формы мониторинга. Жидкости должны вводиться в соответствии с индивидуальными потребностями пациента и регулярно переоцениваться. Оптимизация жидкости должна проводиться осторожно, учитывая четыре основных компонента (TROL): тип жидкости (например, сбалансированный кристаллоид; скорость (100–200 мл за 10 минут); цель (например, нормальное артериальное давление или частота сердечных сокращений); и ограничения (например, высокий уровень центрального венозного давления).
Целью этой фазы является оптимизация и поддержание адекватной перфузии тканей и оксигенации для предотвращения и ограничения повреждения органов. Нужно внимательно проводить мониторинг пациента во время фазы оптимизации: часто требуются несколько типов мониторинга (например, артериальный катетер, эхокардиография, центральное венозное давление, артериовенозные газы крови) для получения наиболее полной картины гемодинамического статуса пациента.
Хотя ресусцитация с ориентацией на микроциркуляторные конечные точки имеет целью улучшить микроциркуляцию, аналогично, может отсутствовать согласованность между макро- и микроциркуляцией. Таким образом, маркеры гипоперфузии должны включать также лактат, удлиненное время наполнения капилляров, для определения степени нарушений микроциркуляции [21, 22].
Следовательно, целью является поддержка перфузии тканей, а жидкости следует рассматривать не только как дополнительную терапию, но и как такую, которая может спасти органы. Баланс жидкости должен измениться с положительного на нейтральный, а целями ресусцитации являются: среднее артериальное давление (MAP) > 65 мм рт. ст., сердечный индекс (CI) > 2,5 л/мин/м², положительный цикл давления (PPV) < 14 %, индекс конечного диастолического объема левого желудочка (LVEDAI) 8–12 см/м². В этой фазе контролируются внутрибрюшное давление (IAP < 15 мм рт. ст.) и артериальное перфузионное давление (APP > 55 мм рт. ст.).
Фаза стабилизации (S). Если пациент стал стабильным, начинается фаза стабилизации, которая длится несколько дней. В этой фазе целью управления жидкостью является обеспечение воды и электролитов для замещения текущих потерь и оказания поддержки органам. Эта фаза гомеостаза сосредоточена на поддержании органов и отражает момент, когда пациент находится в стабильном состоянии, поэтому жидкостная терапия теперь используется только для текущих потребностей замещения теряемых жидкостей или в условиях нормальных потерь жидкости (то есть почечных, желудочно-кишечных, текущих), но также могут быть введены жидкости (включая повторную гидратацию), если пациент испытывает постоянные потери из-за неустраненных патологических состояний.
Однако эта стадия отличается от предыдущих двух отсутствием шока (компенсированного или несколько несбалансированного) или близкой угрозой шока. Идеально, ежесуточно следует измерять вес тела, а кумулятивный баланс жидкости нужно рассчитывать для оценки риска перегрузки жидкостью. Анализ биоэлектрического импедансного анализа (BIA) с расчетом экстра- и внутриклеточной воды (ECW, ICW), общей воды в теле (TBW) и избыточного объема (VE) может предоставить дополнительную информацию. Целью должен быть нулевой или немного отрицательный баланс жидкости.
Фаза эвакуации (Е). После второй стадии сепсиса (см. рис. 1) могут произойти две вещи: либо пациент продолжает восстанавливаться и спонтанно переходит в фазу выведения избытка жидкости, которая не была введена ранее. Однако многие пациенты в отделении интенсивной терапии остаются в состоянии «без выведения жидкости», за которым следует третья стадия шока, обычно вызванная системным синдромом повышенной проницаемости (GIPS), с последующим накоплением жидкости через капиллярную утечку. Дополнительное введение жидкости на этом этапе становится вредным для пациента. Периферический отек и анасарка — это не только косметическая проблема, как считают некоторые, но и опасные для пациента патологические процессы, поскольку приводят к дисфункции органов и могут сами по себе быть причиной полиорганной недостаточности.
Во время первых трех стадий («ROS») жидкости обычно вводятся (сначала как спасательные, затем для поддержки, и наконец как замена основного жидкостного компонента) в последней стадии, фазе эвакуации (что соответствует «Е» в концепции ROSE), жидкость нужно активно выводить из пациента в течение дней или недель, чтобы поддержать восстановление органов. Цель на этом этапе — способствовать отрицательному балансу жидкости через мобилизацию накопленных жидкостей с помощью стратегии позднего целенаправленного удаления жидкости (LGFR), также известной как дересусцитация.
Позднее целенаправленное удаление жидкостей включает агрессивное и активное удаление жидкостей с помощью диуретиков и даже проведение заместительной почечной терапии с ультрафильтрацией, переходом к отрицательному водному балансу. Мониторинг во время этой фазы должен сосредоточиться на оценке перегрузки жидкостью и ее влияния на функцию органов. Недавние исследования показали, что два подряд дня отрицательного водного баланса в течение первой недели пребывания в отделении интенсивной терапии являются сильным и независимым предиктором выживаемости [8, 14, 23, 24].
Очевидно, что риск на этой фазе заключается в том, чтобы не слишком агрессивно выводить жидкость из организма и не вызвать значительную гиповолемию, которая может вызвать «четвертый шоковый удар», что приведет к гемодинамическому ухудшению и гипоперфузии (рис. 1) [8, 14, 25].
При проведении жидкостной ресусцитации всегда возникает вопрос об уместности различных растворов на разных фазах при выполнении вышеупомянутой концепции. Так в фазах ресусцитации и оптимизации авторы склоняются к применению сбалансированных кристаллоидов, однако и теоретически указывают на преимущества перед кристаллоидами коллоидов из-за большей способности к расширению объема плазмы и более длинного периода полураспада в плазме.
В то же время, они имеют недостаток в виде задержки времени свертывания крови и повышения риска повреждения почек. В этом контексте могут быть интересными наблюдения, что в основных исследованиях, указывающих на вредное влияние крахмала, этот коллоид вводился в большом количестве именно в фазе стабилизации, то есть в фазе, которая, возможно, не требовала применения этих препаратов, а это может указывать на не корректные выводы вышеупомянутых исследований. Чаще всего оправдано применение различных типов жидкостей.
Например, многочисленные комбинации растворов могут использоваться в ежедневной практике для ресусцитации: кровь и кристаллоиды (травма), кристаллоиды на ранних этапах (послеоперационная гиповолемия), альбумин на поздних этапах (сепсис). Аналогично, поддерживающие жидкости часто являются комбинацией энтерального и парентерального питания, других растворов, содержащих глюкозу, физиологического раствора и/или сбалансированных кристаллоидов для растворения медикаментов [14, 25, 26, 27].
В этом контексте определенное место, особенно на фазах оптимизации (О) и стабилизации (S) согласно концепции ROSE потенциально может занять отечественный раствор Реосорбилакт (ООО «Юрия-фарм»), учитывая, что в последние годы проведено несколько международных многоцентровых клинических исследований, относительно его эффективности и безопасности применения в комплексной терапии ожоговой болезни (RheoSTAT-CP0669), сепсиса (RheoSTAT-CP0620) и пневмонии (RheoSTAT-CP0698) [28, 29, 30].
Так, в результате исследования этого препарата при лечении тяжелой ожоговой болезни доказано, что Реосорбилакт введен в дозе 7 мл/кг для восстановления гиповолемии, оказывает гемодинамическое действие. Исследованием помповой функции сердца при применении реосорбилакта в динамике установлено, что на 2-е сутки фракция выброса увеличивается на 4 % относительно 1-х суток и на 2 % относительно больных сравнительной группы, что дает основание для применения его на этапе оптимизации (О) [28, 31].
Что касается применения препарата на этапе стабилизации (S), то в ходе исследования терапии ожоговой болезни доказано, что малообъемная ИТ Реосорбилактом в дозе 200–400 мл/сут позволяет уменьшить общий объем инфузии, необходимой для достижения терапевтического эффекта, без риска гипергидратации и перегрузки жидкостью.
Во время данной терапии у пациентов с пневмонией представлены данные об увеличении объема циркулирующей крови, на что указывают существенное повышение ЦВД и стабилизация показателей артериального давления и частоты сердечных сокращений. С другой стороны, после 3-дневного курса инфузий показатели ЦВД не повысились до критически высоких уровней, что позволило уменьшить общий объем инфузии, необходимой для достижения терапевтического эффекта без риска гипергидратации и перегрузки жидкостью, что особенно важно у пациентов старшего возраста с коморбидностью или при критических состояниях, которые имеют особенно неблагоприятный прогноз в случае пневмонии.
При исследовании малообъемной инфузии при сепсисе авторы пришли к подобным выводам об увеличении объема циркулирующей крови на фоне уменьшения общего объема инфузии, необходимой для достижения терапевтического эффекта, таким образом устраняя риск чрезмерной гидратации и перегрузки жидкостью [29, 30].
Итак, несмотря на неоспоримую важность жидкостной терапии в условиях нарушений гомеостаза организма во время больших хирургических вмешательств и критических состояний, где использование внутривенных растворов является одним из наиболее распространенных подходов, идеального раствора не существует. В свете последних исследований необходим пересмотр того, как внутривенные жидкости должны использоваться в периоперационном периоде и при интенсивной терапии критических состояний. Но концепция жидкостной ресусцитации ROSE, которая включает этапы ресусцитации, оптимизации, стабилизации и эвакуации, может помочь в улучшении подходов к управлению жидкостной терапией в клинической практике врача анестезиолога и в медицине критических состояний.
Авторы:
- Дзюба Дмитрий Александрович 1,2
- Недашковский Сергей Михайлович 1
1 КНП КОС «Киевская областная клиническая больница», г. Киев, Украина
2 Национальный университет здравоохранения Украины имени П. Л. Шупика, г. Киев, Украина
Выводы:
- Во время обширных хирургических вмешательств или критических состояний (сепсис, травмы) часто возникают нарушения гомеостаза жидкостей для стабилизации которого необходима адекватная жидкостная ресусцитация.
- Неправильное или чрезмерное введение жидкостей может привести к серьезным последствиям, включая повышенную смертность. Одним из путей решения этой проблемы является индивидуализация терапии, базирующаяся на понимании патофизиологии нарушений, возникающих на каждом этапе критических состояний. Одним из вариантов решения этой проблемы является внедрение в ежедневную практику концепции жидкостной ресусцитации ROSE, которая состоит из четырех этапов: ресусцитация (R), оптимизация (O), стабилизация (S), эвакуация (E). Это позволяет улучшить управление жидкостной терапией / ресусцитацией.
- В контексте жидкостной терапии в критических состояниях является перспективным применение раствора Реосорбилакт, учитывая потенциал согласно исследованиям последних лет, особенно на фазах оптимизации (О) и стабилизации (S), в соответствии с концепцией ROSE.
Литература:
- Edwards, M. R., & Mythen, M. G. (2014). Fluid therapy in critical illness. Extreme Physiology & Medicine, 3, 1-9.
- Hoste, E. A. et al. (2014). Four phases of intravenous fluid therapy: a conceptual model. British Journal of Anaesthesia, 113(5), 740-747.
- Myburgh, J. A., & Mythen, M. G. (2013). Resuscitation Fluids. New England Journal of Medicine, 369, 1243–1251.
- Dellinger, R. P., Levy, M. M., Rhodes, A. et al. (2013). Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Critical Care Medicine, 41, 580−637.
- Marik, P. E., Monnet, X., & Teboul, J. L. (2011). Haemodynamic parameters to guide fluid therapy. Annals of Intensive Care, 1, 1.
- Chowdhury, A. H., Cox, E. F., Francis, S. T., & Lobo, D. N. (2012). A randomised, controlled, double-blind crossover study on the effects of 2-L infusions of 0.9% saline and Plasmalyte® 148 on renal blood flow velocity and renal cortical tissue perfusion in healthy volunteers. Annals of Surgery, 256, 18−24.
- Sanchez, M., Jimenez-Lendinez, M., Cidoncha, M. et al. (2011). Comparison of fluid management in non-septic patients. Anaesthesia and Intensive Care, 39, 1022−1029.
- Malbrain, M. et al. (2014). Fluid overload, de-resuscitation, and outcomes in critically ill or injured patients: a systematic review with suggestions for clinical practice. Anestezjologia Intensywna Terapia, 46(5), 377-396.
- Marik, P. E. (2014). Iatrogenic salt water drowning and the hazards of a high central venous pressure. Annals of Intensive Care, 4, 21.
- Malbrain, M., & Van Regenmortel, N. (2012). Fluid overload is not only of cosmetic concern (Part I): Exploring a new hypothesis. ICU Management, 12, 30−33.
- Messmer, A. S. et al. (2023). Active fluid de-resuscitation in critically ill patients with septic shock: A systematic review and meta-analysis. European Journal of Internal Medicine, 109, 89-96.
- Magder, S. (2016). Volume and its relationship to cardiac output and venous return. Critical Care, 20, 271.
- Miller, T. E., Roche, A. M., & Mythen, M. (2015). Fluid management and goal-directed therapy as an adjunct to Enhanced Recovery After Surgery (ERAS). Canadian Journal of Anaesthesia, 62(2), 158–168.
- Malbrain, M. L. N. G. et al. (2020). Intravenous fluid therapy in the perioperative and critical care setting: executive summary of the International Fluid Academy (IFA). Annals of Intensive Care, 10, 1-19.
- Acheampong, A., & Vincent, J. L. (2015). A positive fluid balance is an independent prognostic factor in patients with sepsis. Critical Care, 19, 251.
- De Oliveira, F. S. et al. (2015). Positive fluid balance as a prognostic factor for mortality and acute kidney injury in severe sepsis and septic shock. Journal of Critical Care, 30(1), 97–101.
- Silva, J. M. Jr et al. (2013). The effect of excess fluid balance on the mortality rate of surgical patients: a multicenter prospective study. Critical Care, 17(6), R288.
- Marik, P. E. et al. (2017). Fluid administration in severe sepsis and septic shock: patterns and outcomes: an analysis of a large national database. Intensive Care Medicine, 43(5), 625–632.
- Cordemans, C. et al. (2012). Aiming for a negative fluid balance in patients with acute lung injury and increased intra-abdominal pressure: a pilot study looking at the effects of PAL-treatment. Annals of Intensive Care, 2(Suppl 1), S15.
- Vincent, J. L., & De Backer, D. (2013). Circulatory shock. New England Journal of Medicine, 369, 1726-3417.
- Vincent, J. L. (2011). Let’s give some fluid and see what happens” versus the “mini-fluid challenge. Anesthesiology, 115(3), 455–456.
- Bennett, V. A., Vidouris, A., & Cecconi, M. (2018). Effects of fluids on the macro- and microcirculations. Critical Care, 22(1), 74.
- Malbrain, M. L. N. G. et al. (2024). Rational Use of Intravenous Fluids in Critically Ill Patients. Springer Nature, 598.
- Cordemans, C. et al. (2012). Fluid management in critically ill patients: the role of extravascular lung water, abdominal hypertension, capillary leak, and fluid balance. Annals of Intensive Care, 2(Suppl 1), S1.
- Malbrain, M. L. N. G. et al. (2018). Principles of fluid management and stewardship in septic shock: it is time to consider the four D’s and the four phases of fluid therapy. Annals of Intensive Care, 8, 1-16.
- Annane, D. et al. (2013). Effects of fluid resuscitation with colloids vs crystalloids on mortality in critically ill patients presenting with hypovolemic shock: the CRISTAL randomized trial. JAMA, 310(17), 1809–1817.
- Myburgh, J. A. et al. (2012). Hydroxyethyl starch or saline for fluid resuscitation in intensive care. New England Journal of Medicine, 367(20), 1901–1911.
- Нагайчук, В. І. et al. (2023). Перші результати міжнародного багатоцентрового клінічного дослідження RheoSTAT-CP0669 щодо ефективності та безпеки інфузійного розчину Реосорбілакт® у комплексному лікуванні пацієнтів з опіковою хворобою. INFUSION & CHEMOTHERAPY, 4, 5-12.
- Шаріпова, В. Х. et al. (2022). Перші результати міжнародного багатоцентрового клінічного дослідження RheoSTAT-CP0620 щодо ефективності та безпеки інфузійного розчину Реосорбілакт® у комплексній терапії сепсису. INFUSION & CHEMOTHERAPY, 2, 11-20.
- Фещенко, Ю. І. et al. (2021). Перші дані міжнародного багатоцентрового клінічного дослідження RheoSTAT-CP0698 щодо ефективності та безпеки інфузійного розчину Реосорбілакт® у комплексній терапії пневмонії. Пульмонологія, 5(498), 18-21.
- Kovalenko, O. M. (2019). Лікування опікового шоку на спеціалізованому етапі. The Ukrainian Journal of Clinical Surgery, 86(8), 55-58.
- Hypertonic saline resuscitation of hemorrhagic shock diminishes neutrophil rolling and adherence to endothelium and reduces in vivo vascular leakage
- urgent.com.ua/ua/archive/2018/1%2870%29/pages-5-13/oglyad-ievropeyskoyi-nastanovi-z-likuvannya-masivnih-krovotech-ta-koagulopatiy-pislya-travmi
- nlm.nih.gov/pmc/articles/PMC10161024/