Окклюзионная болезнь периферических артерий: что мы можем сделать для пациента уже сегодня?

Национальный медицинский университет имени А.А. Богомольца, г. Киев
Окклюзионная болезнь периферических артерий нижних конечностей (ОБПА; облитерирующий атеросклероз артерий нижних конечностей) является важным и очень распространенным проявлением системного атеросклероза, которое приводит к существенному ограничению способности больных к передвижению, снижению качества их жизни и ассоциируется с высоким риском сердечно-сосудистой заболеваемости и смертности [1]. Следует отметить, что согласно современному определению, приведенному в практическом руководстве Американской коллегии кардиологов (ACC) и Американской ассоциации сердца (AHA) (2005), под термином ОБПА понимают атеросклеротическое поражение не только артерий нижних конечностей, но и других периферических сосудов, в частности артерий, кровоснабжающих внутренние органы (за исключением коронарных артерий) и головной мозг [2]. Распространенность ОБПА повышается с возрастом, и у лиц старших возрастных групп без сопутствующей эндокринной патологии, по данным отдельных эпидемиологических исследований, колеблется в достаточно широких пределах (от 2,5% в группе лиц в возрасте моложе 65 лет до 18,8% в группе лиц в возрасте старше 70 лет), составляя в среднем около 12% [1, 3, 4, 8]. Прогноз у па-циентов с ОБПА нижних конечностей в целом неблагоприятен: среди пациентов с перемежающейся хромотой (ПХ) уровень смертности составляет 3–5% в год, среди больных с критической ишемией нижних конечностей — более 20% в год [13].
Как установить диагноз ОБПА, или как часто вы измеряете пациентам АД на ногах?
К сожалению, в условиях реальной клинической практики все еще отмечается гиподиагностика ОБПА. Казалось бы, настороженность практикующих врачей относительно кардио- и цереброваскулярной патологии, в основе которой лежит атеросклероз (ишемическая болезнь сердца (ИБС), инфаркт миокарда, ишемический инсульт), и так достаточно высока. Действия специалистов здравоохранения, направленные на ее профилактику, своевременную диагностику, адекватное лечение и реабилитацию пациентов, уже увенчались значительным успехом, особенно в развитых странах. Удивительно, но ОБПА, в основе развития которой лежит тот же системный атеросклеротический процесс, пока, к сожалению, не стала предметом столь пристального внимания практикующих врачей первичного звена здравоохранения. Вместе с тем ее медико-социальная значимость никак не меньше — это коварное заболевание, многие годы протекающее субклинически, как само по себе существенно снижает качество жизни больных и характеризуется высокими показателями инвалидизации и смертности, так и является очень точным «маркером» высокого риска основных кардио- и цереброваскулярных событий (фатального и нефатального инфаркта миокарда, ишемического инсульта). Характерно, что относительный риск сердечно-сосудистой смерти при ОБПА не зависит от наличия у пациентов проявлений коронарной или цереброваскулярной недостаточности [9, 10]; тяжесть ОБПА тесно коррелирует с риском острого инфаркта миокарда, ишемического инсульта и сосудистой смерти [2, 11].
Между тем диагностика ОБПА не представляет существенных трудностей и фактически доступна любому врачу! Важнейшим критерием установления диагноза ОБПА и показателем выраженности этого заболевания является так называемый лодыжечно-плечевой индекс (ЛПИ, ankle-brachial index — ABI) — соотношение систолического артериального давления (САД), определенного на лодыжке (на a. dor-salis pedis и задней большеберцовой артерии), и САД на руке (на плечевой артерии). Для определения ЛПИ врач может использовать как обычный аппарат для измерения АД, так и аппарат УЗИ. Важно помнить, что измерение САД на обеих ногах и оценку ЛПИ следует проводить после 10-минутного отдыха пациента в положении лежа. В норме ЛПИ составляет 0,91–1,30; клинический диагноз ОБПА нижних конечностей может быть установлен при снижении этого показателя < 0,9. При снижении ЛПИ < 0,4 у пациента констатируют наличие тяжелой ОБПА нижних конечностей. В ряде случаев ЛПИ при ОБПА находится в пределах нормы, но после физической нагрузки снижается на 20% и более. Чем ниже ЛПИ, тем выше риск угрожающих жизни сердечно-сосудистых и цереброваскулярных исходов. Смертность среди пациентов с тяжелой ишемией нижних конечностей, по данным некоторых авторов, достигает 25% в год [5]. О важности рутинной оценки ЛПИ и выявления асимптомного течения ОБПА у всех пациентов с высоким кардио- и цереброваскулярным риском свидетельствуют и результаты последних клинических исследований, выполненных в соответствии с принципами доказательной медицины. Так, в ходе клинического исследования с участием 747 пациентов с диагнозом ишемического инсульта или транзиторной ишемической атаки (ТИА), результаты которого стали доступны онлайн в январе этого года [12], было показано, что снижение ЛПИ < 0,9 отмечается у 18,1% таких больных и достоверно коррелирует с возрастом старше 60 лет (р < 0,0001), а также с анамнезом предшествующих ишемических событий, включая ИБС (р = 0,001), атеросклеротическое поражение сосудов головного мозга (р = 0,002) и фибрилляцию предсердий (р = 0,036). Авторы этого исследования делают вывод, что ЛПИ целесообразно определять у всех пациентов с ишемическим инсультом, так как это поможет не только своевременно диагностировать ОБПА, но и выделить группу больных, подверженных особенно высокому риску повторного острого нарушения мозгового кровообращения и других сосудистых осложнений.
Наиболее важным клиническим проявлением ОБПА нижних конечностей является ПХ, отмечающаяся приблизительно у каждого третьего пациента с этой формой атеросклероза. ПХ характеризуется болями в одной или обеих ногах при ходьбе, которые могут значительно ограничивать способность пациента к передвижению, но обычно значительно ослабевают в покое. Кроме того, при ОБПА нередко наблюдаются судороги и выраженная слабость в ногах, также провоцируемые ходьбой. Как правило, ПХ развивается достаточно медленно. Ее тяжелая форма с выраженной ишемией нижних конечностей (резкие боли в состоянии покоя, трофические язвы, гангрена) отмечается всего в 5–10% случаев, но ассоциируется с очень высоким риском потери ноги. Однако более чем у половины пациентов с ОБПА типичная ПХ не выявляется. Заболевание проявляется у них только уменьшением ЛПИ (0,41–0,90), быстрой утомляемостью при ходьбе, тяжестью в нижних конечностях и снижением качества жизни. Таким образом, в большинстве случаев ОБПА проявляется в основном функциональными нарушениями, ведущими к ограничению подвижности пациентов [1]. Показано, что симптоматические формы ОБПА являются лишь «вершиной айсберга»: количество пациентов с бессимптомным течением заболевания, диагностированного с помощью неинвазивных методов, в 3–4 раза превышает количество тех, у кого отмечается ПХ [13].
В фокусе особого внимания — пациенты высокого риска
Согласно современным представлениям к главным факторам риска развития ОБПА относят возраст старше 40 лет, мужской пол, табакокурение и сахарный диабет (СД). По данным масштабного многоцентрового исследования PARTNERS [6] участие в котором в целом приняли 6979 пациентов, среди лиц в возрасте старше 70 лет, а также в группе лиц в возрасте 50–69 лет, которые курят или больны СД, распространенность ОБПА (оценивалась амбулаторно посредством определения ЛПИ) достигает 29% — то есть данную патологию отмечают практически у каждого третьего. Наличие СД достоверно повышает час-тоту ОБПА — если среди лиц с нормальной толерантностью к глюкозе распространенность ОБПА составляет 12,5% случаев, то при ее нарушении и СД она достигает 19,9 и 22,4% соответственно [7]. Другими важными факторами риска развития ОБПА являются гиперлипидемия, артериальная гипертензия (АГ), гипергомоцистеинемия и повышение уровня С-реактивного белка (СРБ) в плазме крови [2]. Характерный профиль этих факторов, системность атеросклеротических поражений в сочетании с вы-соким риском ишемических сосудистых катастроф служат основанием для проведения при ОБПА мероприятий по вторичной профилактике атеротромботических осложнений, включая агрессивную гиполипидемическую терапию, лечение СД и АГ, назначение антитромбоцитарных средств. К сожалению, до сих пор вторичную профилактику при ОБПА, в частности, гиполипидемическую и антитромбоцитарную терапию, проводят значительно реже, чем, например, при ИБС, хотя ее необходимость при данном заболевании ничуть не меньше [1].
Согласно рекомендациям АСС/АНА (2005) детальное клиническое обследование нижних конечностей с определением пульсации периферических артерий и оценкой ЛПИ в обязательном порядке следует проводить всем лицам с высоким риском развития ОБПА. К ним относятся [2]:
• пациенты в возрасте моложе 50 лет с СД или другими факторами риска развития атеросклероза (курение, дислипидемия, АГ и гипергомоцистеинемия);
• лица в возрасте 50–69 лет, имеющие анамнестические данные о табакокурении и наличии СД;
• лица в возрасте 70 лет и старше;
• пациенты с наличием характерной клинической симптоматики со стороны нижних конечностей, возникающей при физической нагрузке (ПХ) или болевого синдрома ишемического характера, возникающего в состояние покоя;
• пациенты с отклонениями от нормы показателей пульсации артерий нижних конечностей, выявленными при физикальном обследовании;
• пациенты, которым уже установлен диагноз атеросклеротического поражения коронарных, сонных или почечных артерий.
Пациентам, у которых отмечена характерная для ОБПА нижних конечностей клиническая картина или выявлено снижение ЛПИ < 0,9, показано проведение дополнительного инструментального обследования — в первую очередь, ультразвуковой допплерографии и стандартного тредмил-теста. В качестве неинвазивных методов исследования также может быть использовано ультразвуковое ангиосканирование, благодаря которому можно с большей достоверностью определить степень стенотического поражения. В последнее время в диагностике ОБПА все шире применяют дуплексное ультразвуковое ангиосканирование, характеризующееся неинвазивностью, безопасностью для пациента, а также высокой чувствительностью и специфичностью. По данным этого метода определяется не только структура атеросклеротической бляшки, но и оценивается гемодинамическая степень стеноза, что имеет принципиальное значение. Рентгеноконтрастное ангиографическое исследование в настоящее время является основным методом диагностики облитерирующих заболеваний сосудистого русла. С его помощью можно точно определить локализацию, протяженность, степень и характер стеноза, множественность окклюзионных поражений магистральных артерий нижних конечностей, оценить состояние коллатерального русла, прогнозировать характер и объем реконструктивной операции, а также осуществлять контроль за эффективностью лечения и хирур-гического вмешательства. Ангиологи и сосудистые -хирургы используют также такие методы диагностики, как лазерная допплер-флоуметрия, транс-кутанное мониторирование О2, фотоплетизмография, радиоизотопное исследование, компьютерная томография и ядерно-магнитный резонанс [14].
Прогрессирование и исходы заболевания, или что же ждет пациента с ОБПА без лечения?
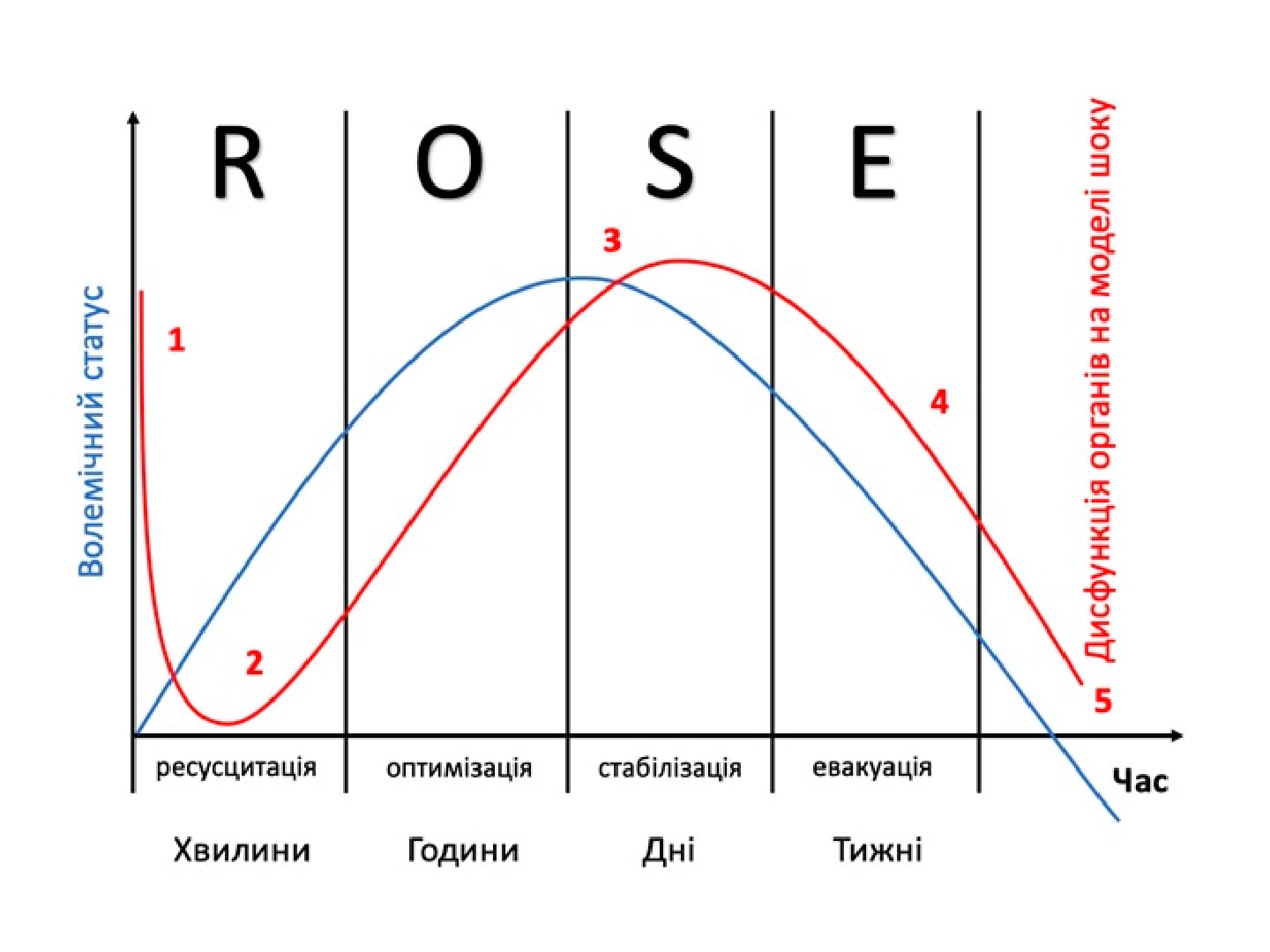
Как уже было отмечено, для пациентов с ОБПА характерен очень высокий риск кардиоваскулярных ишемических событий, поскольку атеросклероз является системным, мультифокальным патологическим процессом, и у подавляющего большинства таких больных наряду с поражением периферических ар-терий выявляют и атеросклеротическое поражение коронарных и церебральных артерий. При этом у пациентов с ОБПА нижних конечностей кардиоваскулярные события развиваются достоверно чаще, чем ишемические осложнения со стороны собственно артерий нижних конечностей [15] (рисунок). При клиническом обследовании в сочетании с регистрацией ЭКГ ИБС диагностируют у 40–60% пациентов с ОБПА, а при коронарографии — у 90% больных [13].
 |
Цереброваскулярные заболевания также очень часто диагностируют у пациентов с ОБПА в качестве сочетанной патологии. Так, у 12–25% пациентов с ОБПА нижних конечностей при проведении дуплексной ультрасонографии выявляют гемодинамически значимые стенозы сонных артерий [16–18]. При этом, как было показано в одном из исследований, приблизительно у 30% пациентов с выраженным стенозом сонных артерий отмечают симптомы ишемии мозга [17]. Установлено, что тяжесть ОБПА коррелирует с выраженностью и протяженностью стеноза сонных артерий [19]. Таким образом, всем врачам, занимающимся ведением пациентов с ОБПА нижних конечностей, следует проявлять особую настороженность в отношении частого наличия у таких больных в качестве сопутствующей патологии ИБС и церебро-васкулярных заболеваний. Вследствие сосуществования указанных патологий у пациентов с ОБПА нижних конечностей отмечается и значительно повышенный риск кардио- и цереброваскулярных осложнений: ИМ, инсульта и смерти вследствие сердечно-сосудистых причин. Риск ИМ у пациентов с ОБПА нижних конечностей повышается на 20–60%, а риск смерти от любых осложнений ИБС — в 2–6 раза. Риск инсульта при наличии ОБПА нижних конечностей повышается примерно на 40%; при этом степень тяжести ОБПА коррелирует с частотой ТИА и инсультов [2].
Современные подходы к консервативной терапии пациентов с ОБПА
Согласно руководству АСС/АНА (2005) по ведению пациентов с ОБПА, одной из главных целей лечения пациентов с ОБПА нижних конечностей должно быть снижение риска кардиоваскулярных событий. У этих больных консервативное лечение следует проводить пожизненно, и оно должно включать воздействие на все модифицируемые факторы риска прогрессирования атеросклероза: отказ от табакокурения, соблюдение гиполипидемической диеты и медикаментозную коррекцию дислипидемии, контроль гликемии при нарушении толерантности к глюкозе и СД, достижение целевых уровней АД, регулярное выполнение физических упражнений. Вторичная профилактика ишемических осложнений у пациентов с ОБПА подразумевает агрессивную гиполипидемическую терапию статинами (уровень доказательности В) и назначение антитромбоцитарных препаратов (уровень доказатель-ности А), однако значение такого рода превентивных мероприятий у пациентов с ОБПА, к сожалению, в ре-альной клинической практике зачастую недооценивается, хотя при этом заболевании они показаны не в меньшей степени, чем при ИБС [1, 2]. С целью снижения риска ИМ, инсульта, застойной сердечной недоста-точности и кардиоваскулярной смертности всем пациентам с ОБПА нижних конечностей и АГ показана антигипертензивная терапия, которая предполагает достижение целевого уровня АД < 140/90 мм рт. ст. у больных без СД и < 130/80 мм рт. ст. — у пациентов с СД и хронической болезнью почек (уровень доказательности А).
У многих пациентов с ОБПА нижних конечностей наблюдается симптоматика ПХ. В настоящее время ее фармакотерапия является отдельной, объективно трудной клинической проблемой. В качестве начального подхода к лечению в руководстве АСС/АНА (2005) предлагаются немедикаментозные мероприятия — регулярные физические упражнения на тредмиле, выполняемые под контролем физиотерапевта или специально обученной медицинской сестры. Рекомендованная продолжительность одного такого занятия составляет 30–45 мин: регулярность их проведения — не менее 3 раз в неделю в течение как минимум 12 нед (уровень доказательности А). На фоне регулярной ходьбы на тредмиле под наблюдением медицинских работников у пациентов с ПХ отмечается уменьшение выраженности симптоматики, увеличение скорости ходьбы и удлинение дистанции безболевой ходьбы [2]. При ПХ может быть рекомендована терапия пентоксифиллином (уровень доказательности С); в настоящее время он рассматривается в качестве альтернативного препарата 2-й линии. За рубежом в качестве высокоэффективного препарата 1-й линии у пациентов с ПХ применяют ингибитор фосфодиэстеразы 3-го типа цилостазол, значительно улучшающий функциональное состояние больных и увеличивающий «безболевую» проходимую дистанцию (уровень доказательности А). Однако в Украине этот препарат пока не зарегистрирован. Что же касается пероральных вазодилатирующих простагландинов (берапрост, илопрост), на которые в свое время возлагались большие надежды в лечении ПХ, то в настоящее время признано, что их применение у данной категории пациентов с целью увеличения дистанции безболевой ходьбы является неэффективным (уровень доказательности А) [2]. Таким образом, с одной стороны на сегодня реальная ситуация с консервативным лечением ОБПА нижних конечностей и ПХ как ее ключевого клинического проявления, к сожалению, все еще оставляет желать лучшего. Но с другой стороны, это стимулирует ученых и клиницистов к активному изучению новых подходов к лечению этого заболевания.
Роль эндотелиальной дисфункции в развитии атеросклероза и практические возможности ее коррекции
Поскольку мультифокальный атеросклероз как системное заболевание требует системных подходов к лечению, в последние годы значительное внимание уделяется поиску новых методов этиопатогенетической терапии ОБПА нижних конечностей как одному из закономерных локальных проявлений данного универсального патологического процесса. Как уже упоминалось, важнейшую роль в комплексном лечении таких больных играет интенсивная гиполипидемическая терапия современными лекарственными препаратами. Вместе с тем этиопатогенез атеросклеротического поражения сосудов очень сложен и многогранен, и помимо нарушений липидного обмена включает еще несколько важных аспектов, центральным из которых на сегодня признана эндотелиальная дисфункция. В настоящее время убедительно доказано, что эндотелий является первым барьером на пути реализации влияния на организм неблагоприятных факторов внешней среды (Furchgott R.F., 1980, Davignon, 2004). Именно снижение нормальной функции эндотелия выступает первым этапом развития атеросклеротического процесса: под воздействием хорошо известных факторов риска постепенно формируется эндотелиальная дисфункция, происходит утолщение интимы сосудистой стенки, образуются атеросклеротические бляшки, что со временем закономерно заканчивается нарушением их целостности и развитием атеротромбоза. Таким образом, нормально функционирующий эндотелий является тем уникальным «биологическим щитом», который непосредственно отвечает за все основные физиологические процессы в сосудах: регулирование тонуса сосудистой стенки, поддержание суспензионной стабильности крови и баланса локальных воспалительных, свободнорадикальных, метаболических и пролиферативных реакций [20]. Эндотелиоциты синтезируют целый ряд биологически активных субстанций, принимающих участие в регуляции воспалительного ответа (ФНО-a, супероксидные радикалы, С-натрийуретический пептид, оксид азота и др.), гемостаза (тромбоцитарный фактор роста, тканевой активатор плазминогена и ингибитор активатора плазминогена, фактор Виллебранда, ангиотензин-IV, эндотелин-1, простациклин, оксид азота), процессов роста и пролиферации (ангиотензин, эндотелин-1, -супероксидные радикалы, простациклин, С-натрий-уретичеcкий пептид, оксид азота) и наконец, в регуляции тонуса гладких мышц сосудов (эндотелин, -ангиотензин II, тромбоксан А2, простациклин, эндотелиальный фактор деполяризации, оксид азота). Лишь взглянув на неполный перечень этих веществ, нетрудно заметить, что центральная роль во всех этих процессах принадлежит оксиду азота (NO) — именно эта молекула оказывает мощное защитное воздействие на все перечисленные функции эндотелия и именно она является главной «мишенью» для фармакологической коррекции эндотелиальной дисфункции. Вопрос о том, как увеличить синтез NO эндотелиоцитами и повысить его биодоступность, на сегодня является одним из самых важных в кардиологии, неврологии и ангиологии: ведь именно таким способом можно добиться снижения прогрессирования атеросклероза и восстановить сосудистый гомеостаз, нарушенный у всех без исключения пациентов с заболеваниями, в основе которых лежит эндотелиальная дисфункция. Одним из подходов к решению этой задачи является применение так называемых донаторов NO, к которым в первую очередь следует отнести L-аргинин (Тивортин) — незаменимый и единственный субстрат для синтеза NO в физиологических условиях. К основным фармакологическим эффектам препарата Тивор-тин, обусловливающим его вазодилататорную и ангиопротекторную активность, можно отнести:
• способность восстанавливать эндотелийзависимую вазодилатацию при атеросклерозе;
• стимуляцию синтеза NO — L-аргинин является субстратом для NО-синтазы (фермента, который катализирует синтез NO в эндотелиоцитах);
• уменьшение адгезии лейкоцитов и тромбоцитов к эндотелию;
• уменьшение агрегации тромбоцитов;
• ингибирование синтеза эндотелина-1, являющегося мощным вазоконстриктором и стимулятором пролиферации и миграции гладкомышечных клеток сосудистой стенки;
• способность угнетать синтез протеинов адгезии VCAM-1 и MCP-1, предотвращая таким образом образование и развитие атеросклеротических бляшек;
• антиоксидантное действие.
Благодаря столь многогранному спектру фармакологической активности, включающему в первую очередь стимуляцию синтеза NO, Тивортин является высокоэффективным эндотелиопротектором, замедляющим прогрессирование атеросклероза. Атеросклероз коронарных и церебральных сосудов сердца, а также периферических сосудов, в том числе с проявлениями ПХ, в настоящее время относят к числу основных показаний к клиническому применению этого препарата.
Терапевтические возможности L-аргинина при ОБПА: результаты рандомизированных клинических исследований
Итак, применение L-аргинина у пациентов с ОБПА является вполне обоснованным и логичным с точки зрения этиопатогенеза атеросклеротического поражения сосудов: установлено, что при ОБПА выражено нарушается опосредованная NO эндотелийзависимая вазодилатация [21], а L-аргинин улучшает этот процесс у пациентов с атеросклерозом и гиперхолестеринемией [22]. О чем же свидетельствуют данные доказательной медицины относительно эффективности L-аргинина у пациентов с ОБПА и ПХ?
В ходе проведенного немецкими учеными двойного слепого плацебо-контролируемого клинического исследования [23] было доказано, что восстановление синтеза NO сосудистым эндотелием, достигаемое при пролонгированном инфузионном введении L-аргинина в дозе 8 г 2 раза в сутки, приводит к значимому улучшению клинического состояния пациентов с ПХ. Так, после 3 нед парентеральной терапии L-аргинином у пациентов было констатировано достоверное увеличение дистанции безболевой ходьбы и максимально проходимой дистанции (р < 0,05). Кроме того, на фоне терапии L-аргинином было констатировано улучшение эндотелийзависимой вазодилатации бедренной артерии — при этом данный эффект не был выявлен на фоне лечения простагландином Е1. Также в данном исследовании было продемонстрировано наличие линейной корреляции между исходным соотношением L-аргинин/ассиметрический диметиларгинин (ADMA) в плазме крови и дистанцией безболевой ходьбы на момент включения в исследование. Известно, что ADMA являются мощным эндогенным стимулятором оксидативного стресса, а аргинин угнетает его синтез. Как показал анализ результатов, полученных после 3 нед введения L-аргинина, такая терапия обеспечивает повышение плазменного коэффициента L-аргинин/ADMA и увеличение экскреции нитратов и циклического гуанозинмонофосфата с мочой, что свидетельствует о нормализации синтеза эндогенного NO.
Интересные результаты об эффектах L-аргинина получены и в другом двойном слепом плацебо-контролируемом рандомизированном клиническом исследовании [25], в ходе которого пациентам с ОБПА и ПХ рекомендовали в течение 2 нед L-аргинин 3,3 г. Период последующего наблюдения пациентов в данном исследовании составлял 8 нед. Было показано, что после 2 нед ежедневного применения 6,6 г L-аргинина у пациентов отмечается увеличение дистанции безболевой ходьбы на 66%, увеличение максимальной дистанции ходьбы на 23% и улучшается качество жизни, согласно опроснику Medical Outcome Survey, — на 10%.
Клинические исследования по применению L-аргинина у пациентов с ОБПА нижних конечностей проводили и в США. В одном из пилотных клинических исследований, участие в котором приняли 80 пациентов с ПХ, была предпринята попытка установить минимально эффективную дозу L-аргинина при данной патологии. Было показано, что у больных с ПХ, в зависимости от условий рандомизации принимавших L-аргинин перорально в дозе 3, 6 и 9 г/сут в течение 12 нед, отмечается тенденция к повышению скорости ходьбы, при этом большее увеличение дистанции ходьбы отмечалось у пациентов, получавших L-аргинин в дозе 3 г/сут. При этом исследователями была отмечена хорошая переносимость L-аргинина и отсутствие на фоне терапии этим препаратом каких-либо значимых побочных эффектов [25].
Как реализовать преимущества L-аргинина в клинической практике?
Восполнить резерв L-аргинина как незаменимого субстрата для синтеза NO в организме пациента с ОБПА и другой сочетанной патологией, в основе которой лежит атеросклероз, усилить NO-опосредованную эндотелийзависимую вазодилатацию периферических артерий, а значит — улучшить клиническое состояние пациента и замедлить темпы прогрессирования поражения сосудов, можно с помощью курсового применения в составе комплексной терапии отечественного препарата L-аргинина Тивортин. Он выпускается в лекарственной форме для парентерального применения (раствор для инфузий) и в форме раствора для перорального применения с удобным дозированием (1 мерная ложка — 1 г препарата). Это позволяет применять Тивортин в комплексном лечении пациентов с ОБПА нижних конечностей и ПХ как на этапе стационарного лечения, так и в амбулаторной практике. Раствор для инфузий Тивортин вводится внутривенно капельно со скоростью 10 капель в минуту в первые 10–15 мин, потом скорость введения можно увеличить до 30 капель в минуту (суточная доза препарата — 100 мл раствора). При пероральном применении Тивортин принимают по 5 мл (1 мерная ложка) во время еды 3–8 раза в сутки (максимальная суточная доза — 8 г).
Таким образом, коррекция эндотелиальной дисфункции в настоящее время является одним из важных элементов системной этиопатогенетической стратегии лечения ОБПА нижних конечностей, которая заслуживает широкого применения в рутинной клинической практике всех врачей, занимающихся ведением данной категории пациентов, в особенности — терапевтов и сосудистых хирургов. В качестве практического инструмента реализации данной терапевтической стратегии комплексного лечения у пациентов с ОБПА нижних конечностей и другими проявлениями мультифокального атеросклероза по праву может рассматриваться незаменимый донатор NO L-аргинин (Тивортин).