Интенсивная терапия тяжелых бронхо-легочных инфекций у детей
Харьковская медицинская академия последипломного образования, кафедра детской анестезиологии и интенсивной терапии,
Харьковская областная детская инфекционная клиническая больница.
В статье представлены результаты применения респираторного фторхинолона левофлоксацина (Лефлоцин компании «Юрия-Фарм»)в практике интенсивной терапии тяжелой пневмонии у ребенка с диссеминированным туберкулезом легких, протекавшем на фоне приобретенного иммунодефицита.
Ключевые слова: синдром приобретенного иммунодефицита, лечение, фторхинолоны.
Проблема использования в педиатрии антибактериальных препаратов группы фторхинолонов представляется достаточно острой и актуальной. Можно констатировать наличие нескольких тенденций в подходе к решению этой проблемы.
Большинство официальных документов, рекомендаций специалистов, инструкций по применению фторхинолонов содержат строгий возрастной ценз, ограничивающий применение фторхинолонов у детей в возрасте до 15 лет. Такая ограничительная политика основана на достаточно известном факте хондро- и артротоксичности нефторированных хинолонов (налидиксовой кислоты, оксолиниевой кислоты, пипемидиновой кислоты), которая была обнаружена в эксперименте у некоторых неполовозрелых животных (в наибольшей степени у собак), а у некоторых животных (мышей) хондротоксичность не была выявлена вовсе. Поражение хрящей у чувствительных к хинолонам видов носило необратимый характер. В то же время, реальные проблемы (в первую очередь, антибиотикорезистентность возбудителей, создающая угрозу жизни как отдельных пациентов, так и целых категорий больных) вынуждают многих клиницистов к более либеральному взгляду на проблему применения фторхинолонов в педиатрической практике.
Результатом подобной тактики явилось выделение некоторых групп пациентов детского возраста, у которых применение фторхинолонов оправдывается мультирезистентностью выделенных возбудителей и жизнеугрожающим характером патологии (синегнойная инфекция у больных муковисцидозом). Однако целый ряд “соблазнительных” качеств современных фторхинолонов (фармакоэкономические характеристики и высокая клинико-микробиологическая эффективность при широком спектре различных по тяжести и локализации инфекций), а также отсутствие каких-либо убедительных подтверждений хондро- и артротоксичности как в детском возрасте (европейский опыт применения фторхинолонов у детей насчитывает около 1 миллиона наблюдений, а установленный риск хондротоксичности у этой группы пациентов составил всего лишь 0,0003 %) [6], так и у взрослых привел к широкому применению фторхинолонов в детских лечебных учреждениях Украины при молчаливом согласии клиницистов и фармакологов.
Рис. 1 “Родословная” фторхинолонов (по Сидоренко С. В., 2001) Красным шрифтом выделены препараты, зарегистрированные в Украине
Интересно отметить, что значительно более артротоксичная, чем фторхинолоны, налидиксовая кислота широко использовалась у детей с 1970 г. и не приводила к каким-либо нежелательным эффектам со стороны опорно-двигательного аппарата (по данным катамнеза) [2]. Между тем, использование хинолонов у детей все же нуждается в серьезном теоретическом, клиническом и микробиологическом обосновании и контроле, что связано с возможностью быстрого распространения устойчивых ко фторхинолонам штаммов, а также наличием других, кроме хондротоксичности, побочных эффектов [4]. Особенно актуальной представляется необходимость уточнить место в педиатрической практике “респираторных” фторхинолонов. К примеру, ципрофлоксацин занял прочное место в практике антибиотикотерапии у детей с муковисцидозом [1], а норфлоксацин и иные фторхинолоны — в лечении бактериальных диарей. Это связано с реальными проблемами современной интенсивной терапии в детской практике (рост устойчивости “домашних” возбудителей верхних и нижних дыхательных путей, ЦНС к макролидам и b-лактамам, увеличение количества детей с различными иммунодефицитными синдромами, возрастание количества мультирезистентных штаммов микобактерий туберкулеза и т. п.). В данной статье мы представляем как литературные данные, так и некоторый собственный опыт использования респираторных фторхинолонов в практике педиатрической интенсивной терапии.
Хинолоны являются производными противомалярийного препарата хлорохина (который, между прочим, без каких бы то ни было ограничений применялся у детей, страдавших малярией, а позднее — различными коллагеновыми заболеваниями). Обнаруженная у этого препарата слабая антимикробная активность послужила толчком к дальнейшим работам, плодом которых стал первый фторхинолоновый антибактериальный препарат налидиксовая кислота — NegGram, разработанный ”Sanofi Synthelabo US в 1962 г”.
На рисунке 1 представлены препараты фторхинолонового ряда, однако не все они нашли применение. Ряд препаратов (грепафлоксацин, тровафлоксацин, тосуфлоксацин), несмотря на высокую антимикробную активность, были исключены из клинической практики из-за высокого риска развития тяжелых, потенциально фатальных осложнений (в частности, влияние на продолжительность интервала Q-T и др.).
Все фторхинолоны проявляют антимикробную активность, связываясь с ферментами топоизомеразой IV и ДНК-гиразой. Кардинальным отличием “респираторных” фторхинолонов от “нереспираторных” является их высокая активность в отношении грам-положительных микроорганизмов (в т. ч. стрептококков и атипичных микроорганизмов — микоплазм и хламидий). При этом активность в отношении большинства грам-отрицательных микроорганизмов практически не изменилась, хотя и вариабельна в отношении семейства Pseudomonas и других неферментирующих бактерий и анаэробов. Высочайшая активность в отношении большинства возбудителей домашних пневмоний, в первую очередь — пневмококка, сделала их препаратами выбора в лечении тяжелых домашних пневмоний у взрослых.
Тщательный обзор литературных данных о фармакодинамических и фармакокинетических свойствах фторхинолонов в совокупности с реальными проблемами антибактериальной терапии в детских отделениях интенсивной терапии стали основанием для углубленного изучения возможности применения левофлоксацина у детей. Одной из наиболее острых остается проблема выбора эмпирической антибактериальной терапии при пневмониях у детей. В этой связи представляется целесообразным сослаться на результаты крупномасштабного исследования TRUST, проводившегося в Северной Америке в 2000–2002 гг. В ходе этого исследования проводилась оценка чувствительности патогенов, выделенных у детей и взрослых с острой воспалительной патологией верхних и нижних дыхательных путей. В исследование вошло 2834 изолята S. pneumoniae, выделенных от детей, и 10 966 изолятов S. pneumoniae, выделенных от взрослых; 629 изолятов H. influenzae, полученных от детей, и 2281 — от взрослых; 389 изолятов M. catarrhalis, выделенных у детей, и 1357 — у взрослых. Очень интересным и важным результатом исследования оказалось установление того факта, что частота выделения полирезистентных штаммов S. pneumoniae существенно превалирует у детей в возрасте до 4 лет. Устойчивые к пенициллинам, триметоприму-сульфометоксазолу и азитромицину штаммы S. pneumoniae у детей в возрасте до 4 лет составили 25,3 %. В иных возрастных группах (дети старше 5 лет, подростки и взрослые) частота выделения штаммов S. pneumoniae, устойчивых к этим антибиотикам, варьировала от 11,9 до 13,7 %. Эти данные, возможно, во многом объясняют факты тяжелого течения пневмоний и высокую частоту неудач антибактериальной терапии у детей раннего возраста. В то же время, к левофлоксацину устойчивыми оказалось лишь 2 штамма S. pneumoniae (0,07 %), а MIC составила 0,25–1 мг/мл. В отношении 90 % изолятов H. influenzae MIC для левофлоксацина составила 0,015–0,6 мг/мл, а M. catarrhalis — 0,03–0,06 мг/мл, что предопределяет высокую эффективность препарата при этих инфекциях [9]. Авторы исследования делают весьма однозначный вывод о том, что применение левофлоксацина у детей представляется весьма обоснованной и высокоэффективной альтернативой [9].
Не менее интересными являются результаты сравнительного исследования эффективности антибактериальной терапии домашних пневмоний у взрослых. В исследовании File T. M. и соавт. (1997) сопоставлялись результаты лечения домашних пневмоний левофлоксацином в дозе 500 мг/сут. и цефтриаксоном в дозе 1–2 г/сут. парентерально в сочетании (или без) с цефуроксимом-аксетилом в дозе 500 мг 2 раза в сутки. Летальность в группе левофлоксацина составила 2 %, в группе сравнения — 5 %; эрадикация возбудителей в группе левофлоксацина составила 98 %, в группе сравнения — 85 % (доверительный интервал 95 %, CI – 21,6 to 4,8); клинический эффект в группе левофлоксацина был достигнут у 96 % больных, в группе сравнения — у 90 % (доверительный интервал 95 %, CI – 10,7 to 1,3); в группе левофлоксацина была достигнута 100 % эрадикация H. influenzae и S. pneumoniae [5].
В другом исследовании изучалась эффективность левофлоксацина при лечении тяжелой внебольничной пневмонии, осложненной бактериемией. Количество пациентов составило 55. Клиническая эффективность левофлоксацина достигнута в 100 %, бактериологическая — также 100 % [8]. Такая высокая эффективность левофлоксацина объясняется следующим образом. Как и для других фторхинолонов, относящихся к дозозависимым препаратам, эффективность антибиотика предопределяется отношением между AUC (площадью под фармакокинетической кривой) и МПК (минимальной подавляющей концентрацией). То есть, чем выше достигается концентрация — тем выше эффект, продолжительность сохранения концентрации большой роли не играет. Для эффективного воздействия фторхинолонов на S. pneumoniae отношение AUC/МПК должно превышать 25–30 [3]. Применение левофлоксацина в дозе 500 мг/сут. однократно обеспечивает в бронхиальном секрете значение AUC/МПК в отношении S. pneumoniae в пределах 115–128, что гарантирует высочайшую антибактериальную активность [3].
Не менее интересным, чем исследования эффективности левофлоксацина при домашних пневмониях, оказалось исследование Geddes A. и соавт. (1999), в котором оценивалась эффективность левофлоксацина при сепсисе. Препаратом сравнения выступал имипенем. В группе левофлоксацина было 140 пациентов, в группе имипенема — 147. Клиническая эффективность левофлоксацина составила 89 %, бактериологическая — 91 %, препарата сравнения — 85 и 87 % соответственно [7]. Не последний фактор, который остановил наш выбор на левофлоксацине, — это фактор безопасности. К 2001 году количество пациентов, получавших этот препарат, превысило 150 млн человек. При этом серьезные негативные стороны и жизнеугрожающие побочные эффекты этого препарата выявлены не были. Другие респираторные фторхинолоны, зарегистрированные на Украинском фармацевтическом рынке (моксифлоксацин, гатифлоксацин), не преодолели тот критический рубеж, когда у пациентов начинают проявляться серьезные нежелательные эффекты при применении препаратов из группы фторхинолонов [3].
И, наконец, возможность step down терапии, обусловленная высочайшей (100 %) биодоступностью препарата при приеме внутрь, также оказалась фактором, который склонил чашу весов в пользу левофлоксацина как объекта исследования в педиатрической практике, в частности, в интенсивной терапии.
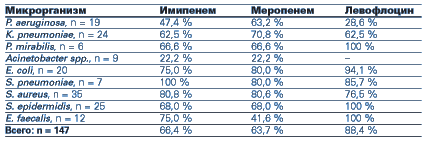
Наше внимание привлек отечественный дженерик левофлоксацина — Лефлоцин компании “Юрия-Фарм”. Привлекательными оказались следующие качества препарата: широкий (приближающийся к карбапенемам) спектр действия, относительно невысокая стоимость курсового лечения. Клиническому применению препарата предшествовало изучение микробиологической активности левофлоксацина (Лефлоцина) в отношении различных возбудителей, выделяемых у пациентов 12-коечного отделения интенсивной терапии Харьковской областной детской инфекционной клинической больницы ОИТ ХОД КБ. В качестве объектов исследования выступали: отделяемое трахеобронхиального дерева, кровь, спинномозговая жидкость, содержимое плевральной и брюшной полостей, которые выделялись у пациентов ОИТ в разные сроки госпитализации. Всего протестировано 147 штаммов микроорганизмов. Исследование чувствительности выделенных микроорганизмов проводилось диско-диффузионным методом. В качестве препаратов сравнения были выбраны карбапенемы как препараты, обладающие максимальной активностью и сверхшироким спектром действия. В сравнении с карбапенемами Лефлоцин уступал в активности в отношении неферментирующих грам-отрицательных микроорганизмов (P. aeruginosa и Acinetobacter spp.) и явно превосходил карбапенемы (особенно меропенем) в отношении S. epidermidis и Е. faecalis. В отношении большинства энтеробактерий, S. аureus и S. рneumoniae эффективность препаратов оказалась сопоставимой (табл. 1).
Табл. 1
Сравнительная активность левофлоксацина и карбапенемов в отношении штаммов микроорганизмов, полученных от больных ОИТ ХОДИКБ в 2003–2004 гг.
Полученные микробиологические данные, подтверждающие высокую активность Лефлоцина in vitro, в совокупности с приведенными литературными данными позволили нам сделать вывод о возможности использования Лефлоцина в определенных клинических ситуациях в интенсивной терапии в педиатрии. Исключив муковисцидоз из числа показаний к назначению Лефлоцина, что вполне понятно, с учетом невысокой противосинегнойной активности препарата, мы сосредоточили внимание на домашних и госпитальных пневмониях у детей, больных ВИЧ-инфекцией. Эта группа пациентов отличается крайне непредсказуемым спектром бактериальных патогенов как в госпитальных, так и в домашних условиях. В связи с оппортунистическими инфекциями, эти больные длительно и без эффекта получают многочисленные курсы антибиотикотерапии, что приводит к колонизации организма резистентными бактериями. Учитывая эти факты, крайне неблагоприятный прогноз течения ВИЧ-инфекции в условиях ограниченных возможностей антиретровирусной терапии, мы сочли возможным применить Лефлоцин у данной категории больных при жизнеугрожающем течении пневмонии либо в режиме монотерапии, либо в сочетании с аминогликозидами, для подавления неферментирующих грам-отрицательных бактерий. Количество наблюдений, которое позволило бы констатировать эффективность препарата инструментами медицинской статистики, пока еще недостаточно. Однако в качестве иллюстрации высокой эффективности Лефлоцина у данной категории больных хотелось бы привести следующее наблюдение.
Ребенок П., 2 года 6 мес., поступил в Харьковскую областную детскую инфекционную клиническую больницу 22.12.2003 г. с диагнозом ВИЧ-инфекция, СПИД, милиарный туберкулез легких. Из анамнеза жизни известно, что ребенок родился от ВИЧ-инфицированной матери, находился на раннем искусственном вскармливании. Многократно переносил респираторные инфекции, дважды находился в отделении интенсивной терапии по поводу гастроэнтероколита, сопровождавшегося развитием выраженного обезвоживания и гиповолемического шока. На момент госпитализации ребенок получал туберкулостатическую терапию изониазидом, рифампицином и стрептомицином. 01.03.2004 г. состояние ребенка начало ухудшаться: появились катаральные явления, лихорадка, одышка, наросли проявления гепатолиенального синдрома. При проведенной в тот же день рентгенографии органов грудной клетки была выявлена двусторонняя очаговая, справа — очагово-сливная пневмония, осложненная правосторонним костальным плевритом. Несмотря на проводимую антибактериальную терапию несколькими антибиотиками широкого спектра действия в сочетании с триметоприм-сульфометоксазолом, состояние ребенка ухудшалось, нарастали проявления дыхательной недостаточности, интоксикации, сердечной декомпенсации. Ребенок был переведен в отделение интенсивной терапии. При поступлении состояние ребенка крайне тяжелое, оценка по шкале SOFA 5 баллов. Вял, адинамичен, стонет. Температура тела 38,7 °С. Кожа бледная, влажная, периоральный цианоз, акроцианоз. Голени пастозны. Микрополиадения. Выражена одышка смешанного характера в покое, частота дыханий 68–72 в минуту, ортопноэ, раздувание крыльев носа, малопродуктивный редкий кашель. Перкуторно над легкими справа в нижних отделах притупление. Аускультативно в легких жесткое дыхание, над областью укорочения ослаблено. SpO2 72 % при FiO2 0,21. Тоны сердца приглушены, тахикардия до 170 в минуту. АД 110/50 мм рт. ст. Живот увеличен в объеме, печень пальпируется на 7,5 см ниже края реберной дуги, селезенка — 3,5 см. Олигоурия. При биохимическом исследовании крови глюкоза крови 5,0 ммоль/л, мочевина 5,0 ммоль/л, К+ 3,99 ммоль/л, Na+ 129,4 ммоль/л, ионизированный Ca++ 1,19 ммоль/л, Cl– 94 ммоль/л, протромбиновый индекс 79 %, фибриноген 2,44 г/л, время свертывания 3 минуты, фибриноген “В” 2+. В клиническом анализе крови: эритроциты 3,2х1012/л, Hb 91 г/л, Ht 0,28, ЦП 0,89, тромбоциты 100х109/л, лейкоциты 5х109/л, эозинофилы 1 %, палочкоядерные нейтрофилы 1 %, сегментоядерные нейтрофилы 65 %, лимфоциты 31 %, моноциты 2 %, СОЭ 48 мм/ч. Протеинограмма: общий белок 74 г/л, альбумины 31,4 %, a-глобулины 6,2 %, b-глобулины 15,6 %, g-глобулины 46,8 %. Печеночные пробы в норме. Иммунологическое исследование — снижение субпопуляции Т-хелперов (СD4) до 160 ед. (норма до 480 ед.), Т-лимфоцитов (CD2, CD3) до 256 ед. (норма 600–1600 ед.), Т-супрессоров (CD8) до 176 ед. (норма 200–400 ед.), иммунорегуляторный индекс 1:0,9 (1:1,5–2,5), количество В-лимфоцитов (CD22) снижено до 32 ед. (норма 200–400 ед.), фагоцитарный индекс снижен до 28 % (норма 40–70 %), фагоцитарное число до 5,9 (норма 8–12), уровень лимфоцитотоксических аутоантител повышен до 28 % (норма до 10 %). При исследовании мокроты были обнаружены микобактерии туберкулеза, грибы рода Candida 10-4 КОЕ и S. рneumoniаe 10-5 КОЕ. При ультразвуковом исследовании сердца была выявлена дилатация левого желудочка, снижение фракции выброса до 45 %. При рентгенологическом исследовании органов грудной клетки отмечалась отрицательная динамика (рис. 2). Начата интенсивная терапия. Обеспечен венозный доступ, начата оксигенотерапия с FiO2 0,5, на фоне которой SpO2 выросла до 92 %. Учитывая длительную терапию различными антибактериальными препаратами, отсутствие эффекта от предыдущего лечения и жизнеугрожающий характер патологического процесса, ребенку был назначен Лефлоцин в/в капельно в суточной дозе 200 мг (20 мг/кг), бисептол-480, продолжено введение противотуберкулезных препаратов (стрептомицин, рифампицин, изониазид, пиразинамид). Посиндромная терапия включала в себя введение гепарина, сердечных гликозидов, эуфиллина, муколитиков, дезагрегантов, инфузию глюкозо-солевых растворов, гепатопротекторы. На фоне проводимой терапии к 13.03.2004 г. температура тела снизилась до субфебрильной, уменьшилась одышка. 16.03.2004 г. переведен в профильное отделение, где 20.03.2004 г. Лефлоцин был отменен и назначен цефтриаксон в дозе 100 мг/кг/сут. Терапия триметоприм-сульфометоксазолом и противотуберкулезными препаратами не прекращалась. После отмены Лефлоцина состояние ребенка начало вновь ухудшаться, нарастала одышка, повысилась температура тела. 25.03.2004 г. вновь переведен в отделение интенсивной терапии в крайне тяжелом состоянии, с проявлениями дыхательной недостаточности, сердечной декомпенсации, интоксикации. При переводе цианоз кожи и слизистых, отеки голеней и стоп, одышка, гипертермия, выражен гепатолиенальный синдром. На рентгенограмме органов грудной клетки констатировано наличие двусторонней субтотальной пневмонии, осложненной правосторонним костальным плевритом. Возобновлена интенсивная терапия, проведена плевральная пункция, вновь назначен Лефлоцин в/в капельно в суточной дозе 200 мг (20 мг/кг), посиндромная терапия. К 29.03.2004 г. состояние ребенка значительно улучшилось — нормализовалась температура тела, уменьшилась одышка. 30.03.2004 г. значительное уменьшение инфильтративных изменений в легких на рентгенограмме. 05.04.2004 г. в стабильном состоянии ребенок переведен в профильное отделение. Повторная отмена Лефлоцина вновь привела к ухудшению состояния, 11.04.2004 г. ребенок вновь переводится в отделение интенсивной терапии в очень тяжелом состоянии. Вновь отмечаются признаки сердечно-легочной декомпенсации, лихорадка, одышка, гипоксемия (SpO2 57 %). Рентгенологически вновь констатируется развитие очагово-сливной пневмонии. Возобновляется терапия Лефлоцином в/в капельно в суточной дозе 200 мг (20 мг/кг) в комбинации с амикацином 20 мг/кг/сут., что приводит к уменьшению одышки, лихорадки, улучшению самочувствия и положительной рентгенологической динамике. 26.04.2004 г. Лефлоцин отменен, назначен моксифлоксацин внутрь в дозе 10 мг/кг/сут. 05.05.2004 г. ребенок вновь переводится в профильное отделение. В последующем еще дважды имели место эпизоды ухудшения состояния и перевода в отделение интенсивной терапии. Все они были связаны с отменой Лефлоцина, сопровождались появлением высокой лихорадки и нарастанием дыхательной и правожелудочковой недостаточности. Они были также успешно купированы на фоне применения Лефлоцина в/в. Эффективность препарата оказалась столь убедительной, что он был назначен в качестве компонента терапии в таблетированной форме. Одним из аргументов к столь длительному применению Лефлоцина послужила не только негативная динамика состояния ребенка при отмене препарата, но и его высокая активность в отношении микобактерий туберкулеза. За этот период времени (с 23.06.2004 по 25.08.2004) ни одного эпизода ухудшения состояния ребенка не наблюдалось, стойко нормализовалась температура тела, уменьшилась одышка, улучшился аппетит. Сохранялась устойчивая положительная рентгенологическая динамика (рис. 2-б). 25.08.2004 г. по настоянию родителей ребенок был выписан из клиники на амбулаторное лечение в стабильном состоянии.
Таким образом, на основании многочисленных литературных данных и собственного опыта использования фторхинолонов у детей, можно сделать вывод о том, что Лефлоцин является препаратом выбора для лечения тяжело протекающих пневмоний у детей, страдающих иммунодефицитными состояниями.






