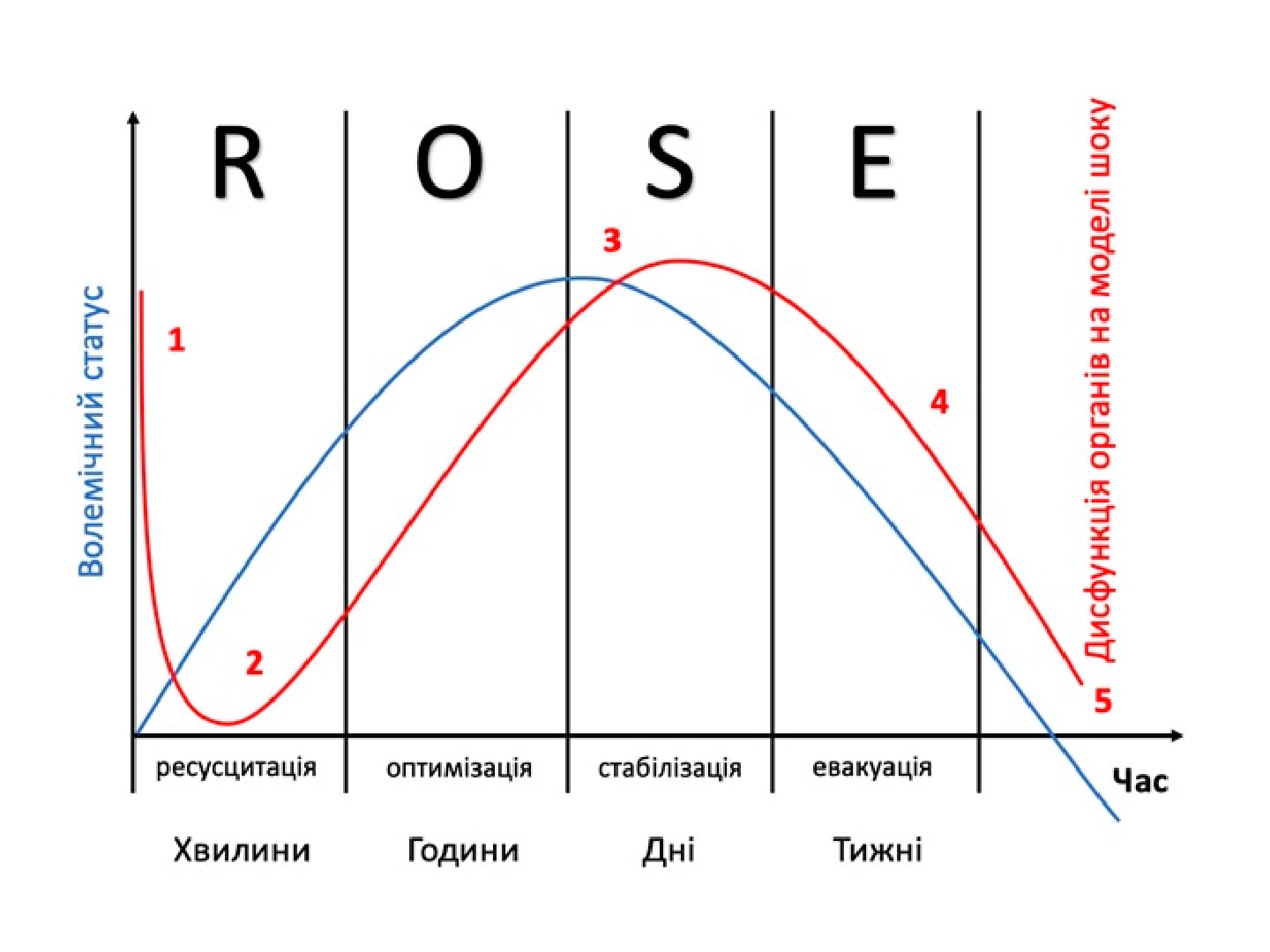
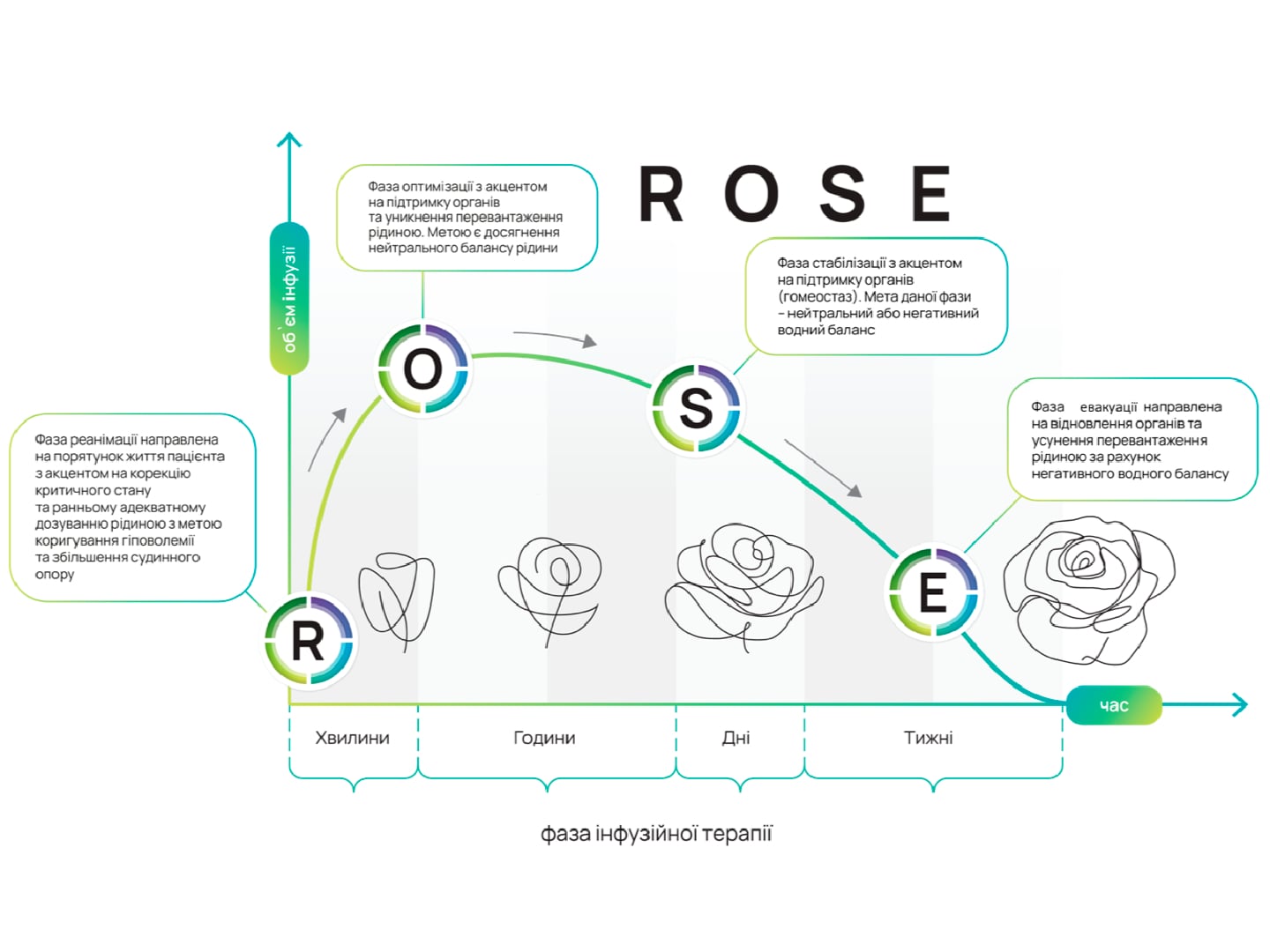
Диференційна інфузійна терапія у хворих на гострий інфаркт міокарда, ускладнений кардіогенним шоком
Вищий державний навчальний заклад України „Українська медична стоматологічна академія”(м. Полтава), вул.Шевченка 23, Полтава, 36000, e-mail: kuch.natalka@mail.ru
Резюме. З метою визначення індивідуальних особливостей перебігу кардіогенного шоку (KШ) у хворих на гострий інфаркт міокарда (ГІМ) для корекції лікування, зокрема інфузійної терапії, дослідили 59 хворих на ГІМ, в тому числі 21, ускладнений кардіогеним шоком. Інфузійна терапія інотропними препаратами в комбінації з Реосорбілактом (ЮРІЯ-ФАРМ) за даними нашого дослідження має позитивний ефект у пацієнтів з Q-інфарктом міокарда, ускладненого кардіогенним шоком, у 81,9% обстежених. Отримані дані підтверджують доцільність диференційної інфузійної терапії у хворих з Q-інфарктом міокарда, ускладненого КШ.
Ключові слова: кардіогенний шок, інфаркт міокарда, інфузійна терапія.
Kардіогенний шок — життєво небезпечний клінічний синдром, який виникає внаслідок гострого порушення функції серця і характеризується ознаками гіпоперфузії тканин внаслідок серцевої недостатності, що зберігається після корекції переднавантаження. Основний пусковий фактор KШ — обширне пошкодження міокарда лівого шлуночка (ЛШ), яке зумовлює неспроможність його насосної функції із суттєвим зниженням серцевого викиду (СВ) та артеріального тиску (АТ). До шоку призводять також дисбаланс між об’ємом крові і діастолічним наповненням ЛШ, виражені порушення тонусу периферичних судин внаслідок розладів гормональної та нервової регуляції. При цьому зазвичай спостерігається артеріальна гіпотонія (систолічний АТ<90 мм рт.ст. або середній АТ>30 мм рт.ст.) та/або зниженням швидкості діурезу <0,5 мл/кг • год (до 30 мл на годину і нижче ). Kрім масивної деструкції серцевого м’яза, виникненню KШ сприяє трисудинне стенозуюче ураження коронарних артерій.[1, 4, 5]
Метою дослідження було визначити індивідуальні особливості перебігу КШ у хворих на ГІМ як передумови до корекції лікування, в тому числі інфузійної терапії.
Завданням дослідження було визначити диференційні підходи до лікування КШ у хворих на ГІМ.
Матеріали і методи
Об’єктом дослідження були 59 хворих на гострий інфаркт міокарда (ГІМ). Середній вік 70,32±6,71;0,90 (середня ± похибка; стандартна девіація), максимум – 83 роки, мінімум – 60 років ), в тому числі 46 (78 %) з підйомом сегмента ST та глибоким зубцем Q або комплексом QS та 13 ( 22 %) без підйому сегменту ST та глибокого зубця Q . 21 (35,6 %) хворих із 59 мали повторний ГІМ. У 21 (35,6 %) із 59 хворих ГІМ ускладнився кардіогенним шоком.
Обстеження хворих проводилось згідно стандартів України, що включало, окрім загальноклінічних обстежень, детальний аналіз та співставлення морфометричних даних передсердь та шлуночків ехокардіографічно та результатів дослідження змін де- та реполяризації серця електрокардіографічно, біохімічних маркерів ГІМ, стану коагуляційної та фібринолітичної властивостей крові. Всім хворим проводилось моніторування АТ, ЧСС, сатурації (ступеня насичення гемоглобіну артеріальної крові киснем ), частоти дихання та ЕКГ (за допомогою монітора UTAS UM 300). Хворим на ГІМ, що ускладнений кардіогенним шоком проводили катетеризацію сечового міхура з метою виявлення олігоурії (анурії).
Статистичний аналіз включав параметричні та непараметричні методи. Нормальність розподілу варіацій перевіряли за значенням коефіцієнтів асиметрії й ексцесу, результатами однофакторного тесту Колмогорова-Смирнова з корекцією за Lilliefors, W тесту Shapiro-Wilks (за програмою SPSS for Windows Release 13.00, SPSS Inc., 1989-2004). Якщо варіабельності не мали нормального розподілу, то використовували непараметричні методи статистики (за програмою SPSS for Windows Release 13.00, SPSS Inc., 1989-2004), зокрема, Mann-Whitney U (MW). Розходження між групами також визначали за допомогою непараметричниого методу – критерій знаків (КЗ). Для оцінки розходжень категоріальних варіабельностей використовували точний метод Фішера (ТМФ) ( за програмою Statistica for Windows Release 5.1, 1984-1998 by StatSoft, Inc.).
Результати та їх обговорення
При обстеженні 59 хворих на ГІМ було виявлено, що у 21 хворого інфаркт міокарда був ускладнений кардіогенним шоком, з них 4 – аритмогенним, 6 – істинним та 11 – рефлекторним.
Аналіз наявності гострої серцевої недостатності у хворих на ГІМ в залежності від попереднього ремоделювання серця дозволив визначити певні закономірності (табл.).
Фракція викиду була меншою у хворих на ГІМ, що ускладнився КШ, в порівнянні з тими що його не мали. Цьому сприяли зниження товщини міжшлуночкової перегородки, задньої стінки лівого шлуночка та маси міокарда лівого шлуночка.
Кінцевий систолічний розмір лівого шлуночка у хворих на ГІМ був виражено більшим у хворих з КШ на відміну від хворих без гострої серцевої недостатності.
Виражене ремоделювання серця, особливо переважання гіпертрофії міжшлуночкової перегородки та задньої стінки лівого шлуночка було передумовою утворення інфаркту міокарда в цих ділянках.
Таблиця
Показники ехокардіографічної морфометрії у хворих на гострий інфаркт міокарда в залежності від наявності чи відсутності кардіогенного шоку (M± SEM, SD)
|
Показники |
Хворі на гострий інфаркт міокарда в залежності від наявності чи відсутності кардіогенного шоку: |
|
|
Без кардіогенного шоку (n=38) |
З кардіогенним шоком (n=21) |
|
|
1 |
2 |
3 |
| Кінцевий систолічний розмір лівого шлуночка, КСР ЛШ (мм) | 44,32±0,89; 4,47; | 53,18±2,51; 5,63 Pmw 1-2 = 0,029 |
| Фракція викиду, ФВ (%) | 44,60±2,01; 10,03; | 30,78±6,11; 13,52;
Pmw1-2 = 0,044 |
| Товщина міжшлуночкової перетинки, ТМШП (мм) | 12,58±0,33; 1,66 | 10,22±6,07; 13,61; Pmw1-2= 0,012 |
| Товщина задньої стінки лівого шлуночка, ТЗСЛШ (мм) | 12,12±0,28; 1,39; | 8,23±2,02; 4,59;
Pmw1-2 = 0,032 |
| Відносна товщина міокарда | 0,43±0,01; 0,06; | 0,31±0,04; 0,07;
Pmw1-2 = 0,002 |
| Маса міокарда лівого шлуночка за формулою L. Teicholz (г) | 431,68±11,86; 59,32; | 312,04±34,13; 82,46; Pmw1-2 = 0,002 |
Примітки: M – середня, SEM – стандартна похибка, SD – стандартне відхилення. Pmw – різниця між групами хворих на інфаркт міокарда за даними непараметричного еквіваленту до двохвибіркового t тесту Ст’юдента – тест Mann-Whitney (mw).
Лікування КШ у хворих на ГІМ спрямоване на швидке вирішення наступних діагностичних та терапевтичних завдань: 1. Оцінка стану життєво важливих функцій організму. За відсутності спонтанних дихальних рухів – інтубація та штучна вентиляція легень; корекція гіпоксемії шляхом призначення кисню, катетеризація сечового міхура з метою моніторування кількості сечі. 2. Швидке забезпечення доступу до периферичної вени. 3. Початок стабілізації стану гемодинаміки та відновлення кровопостачання життєво важливих органів шляхом введення позитивних інотропних засобів – при наявності ознак перевантаження об’ємом, а також після адекватного поповнення ОЦK. [2, 3, 6, 7]
У хворих з рівнем систолічного АТ менше 70 мм рт. ст. і клінічними проявами KШ використовували дофамін 4-5 мкг/кг/хв в поєднанні з реосорбілактом (ЮРІЯ-ФАРМ). Останній завдяки своєму збалансованому електролітному складу за кальцієм, калієм та магнієм, з надлишковим вмістом натрію у вигляді двох солей – хлориду і лактату нормалізує метаболізм міокарду та підсилює дію дофаміну. За даними наших клінічних досліджень 81,9% хворих з Q-інфарктом міокарда, ускладненого кардіогенним шоком, мали позитивний ефект від поєднаного застосування цих препаратів.
Якщо тяжка артеріальна гіпотензія (систолічний АТ менше 80 мм рт. ст.) і клінічні прояви KШ зберігалися на фоні дофаміну у дозі понад 15 мкг/кг/хв, додавали інфузію норадреналіну. [8, 10, 11]. Орієнтовна початкова доза норадреналіну становила 10—15 крапель за хвилину, швидкість підтримуючої інфузії складала 0,5—30 мкг/хв, залежно від динаміки АТ і частоти серцевих скорочень. Нами враховувалось, що інфузія норадреналіну повинна бути якомога менш тривалою: інтенсивне звуження периферичних судин внаслідок введення препарату пов’язане зі стазом крові в капілярах і переходом рідини з судинної системи у тканини, що зумовлює втрату чутливості до препарату і посилення шоку. Критерієм ефективності лікування було досягнення середнього АТ понад 70 мм рт. ст.
У випадку ознак набряку легень внутрішньовенно вводили фуросемід (10—20 мг) [6, 9] .
Тромболітична терапія – один із найсучасніших методів лікування ГІМ, що дозволяє відновити перфузію міокарда та зберегти його життєздатнісь. За відсутності протипоказань тромболітичну терапію проводили препаратами актелізе, металізе з подальшим системним введенням антикоагулянтів [12, 13].
Аритмогенний варіант КШ передбачає проведення заходів, що спрямовані на стабілізацію серцевого ритму. При брадиаритміях (ЧСС < 50 уд/хв) до лікування додавали 0,5 – 1 мг атропіну. При виявленні на моніторі шлуночкових екстрасистол, пароксизмальних тахікардій (ЧСС > 150 уд/хв) застосовували кордарон, який не лише обриває тахіаритмії, але й покращує коронарний кровоток.
Рефлекторна форма КШ зумовлена неважким ураженням міокарда, а різким зниженням тонусу периферичних судин, частіше за все у відповідь на сильний біль. Тому в лікуванні цієї форми шоку ми використовували наркотичні анальгетики (морфін).
Істинна форма КШ зумовлена різким зниженням насосної функції ЛШ. Тому у частини хворих введення вазопресорних препаратів не призводить до підвищення АТ. Умова формування істинного KШ — некроз 40-50% маси міокарда ЛШ. Лікування цієї форми КШ включало комплекс інфузійної терапії: аналгезія (морфін внутрішньовенно болюсно), тромболітична терапія (актелізе, металізе), інотропна підтримка (допамін, добутамін).
Висновки:
1. Виражене ремоделювання серця, особливо переважання гіпертрофії міжшлуночкової перегородки та задньої стінки лівого шлуночка було передумовою утворення інфаркту міокарда в цих ділянках.
2. Фракція викиду була меншою у хворих на ГІМ, що ускладнився КШ, в порівнянні з тими що його не мали.
3. Інфузійна терапія інотропними препаратами в комбінації з Реосорбілактом (ЮРІЯ-ФАРМ) за даними нашого дослідження має позитивний ефект у пацієнтів з Q-інфарктом міокарда, ускладненого КШ у 81,9% обстежених.
4. Отримані результати підтверджують доцільність диференційної інфузійної терапії у хворих з Q-інфарктом міокарда, ускладненого КШ.