Вплив лікування на динаміку вовчакового антикоагулянту при множинній мієломі
ДУ «Інститут патології крові та транс фузійної медицини АМН України», м. Львів
РЕЗЮМЕ. На наявність ефектів вовчакових антикоагулянтів (ВА ) обстежено у 19 хворих на множинну мієлому (ММ). Активність ВА виявлено у 6 (31,6%) з 19 хворих на ММ. У 1 хворої вивчено динаміку ВА під час лікування. Виникнення антифосфоліпідних антитіл (АФЛА) при ММ є одним з проявів аутоімунного ускладнення перебігу хвороби, яке спричинене порушенням антитілогенезу. Методом лікування ВА при ММ є комплексна терапія хвороби.
Ключові слова: множинна мієлома, гіпервіскозний синдром, антифосфоліпідні антитіла, вовчаковий антикоагулянт, плазмаферез, гормонотерапія.
Вступ. Множинна мієлома (ММ) – моноклональний пухлинний процес з атипових плазмоцитів, розвиток якого пов’язаний з проліферацією та накопиченням імуноглобулін-секретуючих В-клітин. Характерною ознакою хвороби є продукування мієломними клітинами патологічного білку – парапротеїну.
Крім болю у кістках, гіперкальціємії, нормохромної анемії, ураження нирок, бактеріальних інфекцій захворювання характеризується геморагічними проявами та гіпервіскозним синдромом. Цей синдром супроводжується дифузною кровоточивістю неврологічними проявами, амілоїдозом та гіперволемією. Порушення у системі зсідання пояснюються взаємодією парапротеїну з прокоагулянтами (ФV, ФVII, ФVIII, ФІІ, фібриногеном, фактором Віллебранда) та/або мембранами (рецепторами) тромбоцитів, що у 30-55% випадків викликає зниження кількості тромбоцитів та порушення їх агрегативної функції [1, 2].
Крім змін у системі зсідання, у хворих на ММ досить часто виникають аутоімунні розлади, але про появу у них антифосфоліпідних антитіл (АФЛА)/вовчакового антикоагулянту (ВА) відомості майже відсутні. АФЛА/ВА це гетерогенна популяція бімодальних аутоантитіл (підкласів IgG, IgM, IgА або їх суміш), що розпізнають детермінанти аніонних та нейтральних фосфоліпідів (ФЛ) та комплексні епітопи, які утворюються в процесі взаємодії ФЛ та глікопротеїнів (білків-кофакторів). Є поодинокі дані, що парапротеїни можуть неімунологічно інгібувати зв’язки між факторами зсідання та фосфоліпідами і таким чином відповідати за вовчакоподібну антикоагулянтну активність [2-4]. Немає достатньої кількості даних щодо клінічного значення та методів лікування ВА у хворих на ММ. У багатьох хворих на ММ у комплексі з цитостатичною терапією та гормонотерапію застосовують методи екстракорпорального очищення крові (плазмаферез, гемосорбцію), особливо при гіпервіскозному синдромі, нирковій недостатності, високому вмісті парапротеїну.
Оскільки у хворих на ММ природа ВА, його роль у патологічному процесі та методи лікування ще недостатньо з’ясовані, метою нашого дослідження було вивчити вплив ВА на систему зсідання з відповідними клінічними проявами та дослідити динаміку антикоагулянту під час проведення терапії.
Матеріали і методи досліджень. Дослідження виконано у 19 хворих на ММ (13 чоловіків 3 жінки), які знаходилися на обстеженні і лікуванні у базових клінічних відділеннях інституту. У всіх хворих проведено загальні клініко-лабораторні дослідження, необхідні для встановлення діагнозу, та коагулологічні аналізи. Клініко-лабораторні дослідження включали клінічне обстеження, гематологічні, цитологічні, біохімічні та імунологічні аналізи. Для загальної оцінки функціонального стану системи гемостазу виконували скринінгові коагулологічні дослідження. Судинно-тромбоцитарний гемостаз оцінювали на підставі кількості тромбоцитів, їх розміру та форми, оцінки агрегації тромбоцитів під дією агоністу АДФ. За уніфікованою методикою одностадійного кількісного визначення проводили дослідження активності факторів зсідання VIII (IX) [5]. Визначення активності інгібітору до фактора VIII (IX) проводили за методикою Kasper (1975) в модифікації Р.Н. Хаметової і співавт. [5, 6].
Діагностику ВА проводили на основі послідовного виконання трьохетапного комплексу коагулологічних тестів для виявлення активності ВА відповідно до міжнародних критеріїв, які були розроблені і рекомендовані Subcommittee on lupus anticoagulant/ antiphospholipid antibodies SSC ISTH [7-10].
І. Скринінгові тести (І етап)– тести на основі фосфоліпідів різного походження (фосфоліпід-залежні тести):
– каоліновий час зсідання у безтромбоцитній плазмі (КЧБТП).
– активований парціальний тромбопластиновий час (АПТЧ) з основною концентрацією АПТЧ-реагенту у БТП (АПТЧБТП), індекс АПТЧ (ІАПТЧ).
– АПТЧ із зниженою концентрацією АПТЧ-реагента (АПТЧзн, індекс АПТЧзн (ІАПТЧзн)
– протромбіновий час (ПЧ) з розведеним тромбопластином 1:50, 1:500 (ПЧ1:50,ПЧ1:500), індекси ( ІПЧ1:50,ІПЧ1:500).
– тест з розведеною фосфоліпід-залежною отрутою змії Гюрзи середньоазійської (Vipera lebetina turanica) – лебетоксовий тест, індекс лебетоксового тесту (ІЛ). Процедуру приготування розведеної отрути описано у літературі [6].
У групі скринінгових тестів паралельно визначають відповідний показник у нормальній БТП і розраховують індекс для кожного тесту як співвідношення часу зсідання у дослідній плазмі до відповідного часу зсідання у нормальній плазмі. За прояв гіпокоагуляції вважають подовження часу зсідання на 10 с або на 20% та більше. При позитивному результаті хоча б двох скринінгових тестів слід перейти до наступного етапу.
ІІ. Корекційні тести (ІІ етап)– тести, які виключають дефіцит коагуляційних факторів зсідання. Нормалізація подовжених скринінгових тестів при доданні до системи невеликої кількості (у співвідношенні 1:4 або 1:1) нормальної БТП вказує на дефіцит прокоагулянтів. Відсутність корекції може означати наявність ВА.
ІІІ. Тести на підтвердження наявності ВА (ІІІ етап)– підтверджують фосфоліпід-залежну природу інгібітору:
– співвідношення АПТЧ у БТП (АПТЧБТП) і АПТЧ у плазмі із зруйнованими шляхом заморожування і розморожування тромбоцитами однієї особи (ІАПТЧ). Процедуру отримання зруйнованих тромбоцитів та формула обчислення ІАПТЧ описано у літературі [8]. За наявності ВА ІАПТЧ перевищуватиме 16,4%;
– різниця АПТЧ у БТП на 2-й (АПТЧ2) і 10-й (АПТЧ10) хвилині її інкубації при 37°С. Виконують у тесті АПТЧ та у АПТЧзн. Вкорочення АПТЧ10 більше, ніж на 11 с вказує на наявність ВА;
– лебетокс/ехітоксовий індекс (ІЛ/Е) – аналог текстарин/екаринового індексу. На основі отрути змії ефи виконують ехітоксовий тест. Паралельно визначають ехітоксовий час у контрольній плазмі і вираховують ехітоксовий індекс (ІЕ), як співвідношення ехітоксового часу досліджуваної плазми до ехітоксового часу контрольної плазми. Потім розраховують співвідношення (ІЛ/Е) за результатами лебетоксового та ехітоксового часу зсідання за формулою:
ІЛ/Е= ІЛ / ІЕ
В нормі індекс ІЛ/Е дорівнює 0,8±0,2 при мануальному визначенні. Зростання показника ІЛ/Е більше ніж 1,2 свідчить про наявність в плазмі ВА.
Позитивний результат двох чи більше тестів на підтвердження свідчить про наявність активності ВА у дослідній плазмі.
Результати та їх обговорення. У 6 (31,6%) з 19 хворих на ММ виявлено активність ВА. Дослідження динаміки наявності активності ВА було виконано у 1 хворої Г. на ММ ІІ ст., 1941 р.н. Пацієнтка скаржилась на слабкість, болі у хребті, втрату ваги тіла, носові кровотечі. Загальний стан оцінювався як тяжкий. У хворої була анемія (Hb – 60г/л), дещо знижена кількість тромбоцитів (150×109/л), субфебрильна температура. На фоні високого парапротеїну в крові розвинувся гіпервіскозний синдром, а пізніше ниркова недостатність (сечовина крові – 16,1мм/л, креатинін крові – 0,38мм/л, білок у сечі-2,64 г/л, еритроцити – до 10 в п/з)
Хвора Г. отримала 2 курси лікування. 1-й курс включав 3 сеанси плазмаферезу (14.12.2005р., 17.12.2005р., 21.12.2005р.), пульс-терапію дексаметазоном 40 мг 4 дні №3: 15-18.12.2005р.; 23-26.12.2005р.; 31-12.2005р.-03.01.2006р, замісні гемотрансфузії, дезінтоксикаційну та антибактеріальну терапію. Під час 2-го курсу проведено 2 сеанси плазмаферезу (20.01.2006 р. та 26.01.2006 р.), пульс-терапію дексаметазоном 40 мг 4 дні №4: 18-21.01.2006р.; 26-29.01.2006р.; 03-03.02.2006р.; 11-15.02.2006, замісні гемотрансфузії, дезінтоксикаційну та антибактеріальну терапію.
Всі 5 сеансів плазмаферезу виконувались за однаковою схемою. Під час кожного сеансу гепаринизація – 12т од. в/в (150 од. на кг м.т.). Під час операції за 3 цикли видалялось 1,2-1,5 л плазми (приблизно 35-40% ОЦП). Плазмозаміщення: р-н 0,9% NaCl 2,0л + р-н Реосорбілакту 400,0 мл + дексаметазон 8 мг + р-н 10% глюконату Ca 10,0мл + панангін 10,0 мл. Хвора операції переносила добре. Стан пацієнтки під впливом кожного курсу плазмаферезу суттєво покращувався.
З метою вивчення динаміки ВА під час лікування хворої на ММ нами 4 рази було проведено дослідження виявлення активності ВА: до початку лікування (14.12.2005р.), після 3-х сеансів плазмаферезу (23.12.2005р.), після закінчення 1-го курсу лікування (04.01.2006р.) та після плазмаферезу 2-го курсу лікування (30.01.2006р.). Дані про динаміку коагулологічних показників, µ-градієнту, кількості тромбоцитів та геморагічних проявів під час лікування хворої подано у таблиці.
Як видно з таблиці, до початку лікування (14.12.2005р.) у пацієнтки за коагулологічними ознаками було діагностовано ВА. У трьох скринінгових тестах (тестах І етапу) була наявна гіпокоагуляція : КЧ подовжений до 147,0 с (при нормі 90,0 с), ІАПТЧбтп зростає до 1,45 (норма <1,2) та ІЛ становить 1,8 (при нормі <1,2). Нормалізації порушених показників при доданні нормальної плазми у співвідношенні 1:1 не спостерігалось (див табл). Три тести на підтвердження фосфоліпід-залежної природи інгібітору (ІІІ етап) були позитивними, що свідчить про наявність ВА: ІАПТЧ становив 39% (при нормі 16,4%), різниця між АПТЧ на другій хвилині інкубації (АПТЧ2) та десятій хвилині інкубації (АПТЧ10) > 11 с, IЛ/Е був збільшений до 2,3 (при нормі 1,2).
Після трьох сеансів плазмаферезу 1-го курсу лікування (23.12.2005р) показники скринінгових тестів знаходились в межах норми, що свідчить про відсутність ендогенного антикоагулянту. Дослідження на виявлення ефектів антикоагулянтів вовчакового типу було виконано нами ще два рази, але ознак ВА більше не спостерігалось. Як видно з таблиці, активність факторів зсідання VIII (ІХ) за умови наявності ВА та його відсутності була в межах норми. Інгібіториних антитіл до ФVIII (ІХ) під час досліджень жодного разу не виявлено.
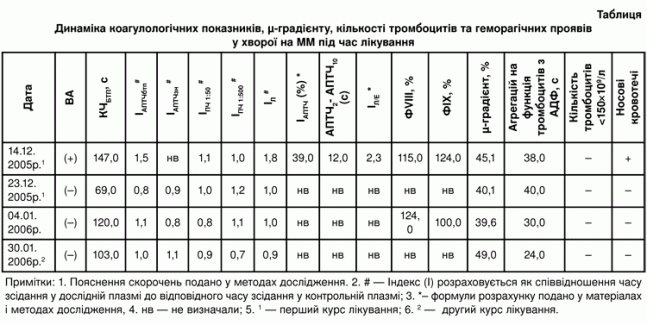
Протягом 1-го та 2-го курсів лікування показник µ-градієнту хворої змінювався незначно. Вміст парапротеїну дещо знижувався після 1-го курсу лікування з 45,1% до 39,6% та під час 2-го курсу терапії зростав до 49,0%. Треба відзначити, що агрегативна функція тромбоцитів з АДФ весь час залишалась порушеною (>18 с), хоча суттєвого зниження кількості тромбоцитів не відмічалось. Носові кровотечі припинились вже після трьох сеансів плазмаферезу у комплексі з пульс-терапією дексаметазоном та більше не турбували хвору (див.табл.).
Отже, у пацієнтки були наявні всі ознаки гіпервіскозного синдрому (високий вміст µ-градієнту, зниження кількості тромбоцитів та дезагрегативні зміни їх функції), який супроводжувався геморагічними проявами. Перебіг захворювання ускладнювався появою аутоімунних антитіл, зокрема ВА, які виникають в результаті порушення антитілогенезу.Зникненняактивності ВА, зменшення проявів гіпервіскозного синдрому та припинення кровоточивості відбувається після трьох операцій плазмаферезу у комплексі гормонотерапією. Ефект плазмаферезу пов’язаний із швидким вилученням з кровообігу патологічних антитіл, які у надлишковій кількості продукуються мієломними клітинами, також токсичних та метаболічних компонентів крові. Не тільки цитостатична, але й імуносупресивна дія дексаметазону сприяє пригніченню антитілогенезу та зникненню ефектів антикоагулянтів вовчакового типу (ВА). Загалом, 2 курси терапії призвели до значного покращення стану хворої на ММ та перебіг захворювання у подальшому можна охарактеризувати як стабільний.
Отримані нами результати, які співпадають з літературними даними [1], свідчать, що основним методом лікування АФЛА при ММ є комплексна терапія базового захворювання, спрямована на зниження рівня парапротеїну (плазмаферез, гормоно- та дезінтоксикаційна терапія).
Висновки:
1. Множинна мієлома у 31,6% випадків може супроводжуватись виникненням антифосфоліпідних антитіл, зокрема вовчакового антикоагулянту.
2. У хворої Г. на множинну мієлому вовчаковий антикоагулянт, поява якого спричинена порушенням антитілогенезу, є одним з проявів аутоімунного ускладнення перебігу захворювання.
3. Ефекти антикоагулянтів вовчакового типу (ВА) зникають під час 1-го курсу лікування після трьох сеансів плазмаферезу у комплексі гормонотерапією та більше не спостерігаються.
5. Методом лікування анифосфоліпідних антитіл при множинній мієломі є комплексна терапія основного захворювання.